Zvětšování a zmenšování kruhů
Zvětšování a zmenšování kruhů je označení pro, zpravidla organické, chemické reakce, které mění velikost kruhů. Při těchto reakcích většinou vznikají a zanikají vazby C-C.[1] Reakce tohoto druhu mohou probíhat mnoha různými mechanismy.
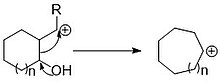
Demjanovovy reakce
editovatDemjanovovy reakce spočívají v diazotaci aminocyklobutanů a aminocyklopropanů. Oddělení dusíku z diazoniových kationtů vede k tvorbě karbokationtů, které se přesmykují a následně jsou hydrolyzovány. Těmito reakcemi se mění aminocyklobutany na směsi hydroxycyklobutanů a hydroxymethylcyklopropanů; v jejich průběhu se vytváří rovnováha mezi dvojicí karbokationtů:[2]
- C4H +
7 ⇄ C3H5CH +
2
Karbenoidová zmenšování kruhů
editovatPři Arndtově–Eistertově reakci uvolňuje α-diazoketon molekulu N2, čímž vzniká vysoce reaktivní sextetový uhlík v sousedství karbonylové skupiny. Takto vzniklý meziprodukt prochází Wolffovým přesmykem za tvorby esteru. Při použití cyklických α-diazoketonů dojde ke zmenšení kruhu;[3][4] například u steroidů se takto přeměňují cyklopentanonové kruhy na cyklobutanové.[5]
Rozšiřování kruhů
editovatRozšiřování kruhu umožňují vytváření větších systémů, které se ostatními způsoby získávají obtížně.[6] Tyto reakce mohou probíhat prostřednictvím reakcí skupin již navázaných na vnější stranu kruhů (pak se jedná o migrační inserce), otevíráním bicyklických molekul za vzniku jednoho většího kruhu, nebo přes uzavírání kruhů.[1]
Rozšiřování kruhů lze dále rozdělit podle druhu atomů (uhlík nebo heteroatom) zapojených do rozšiřovaných kruhů.
Inserce uhlíku při přesunech na exocyklické skupiny
editovatTyto reakce zahrnují exocyklické odstupující skupiny na uhlíkových atomech sousedících s kruhem a skupiny dodávající elektrony na kruzích, které mohou spustit přesun endocyklických vazeb.
Příkladem může být pinakolový přesmyk.[1] Toto označení se používá pro vicinální dihydroxidové přesmyky, ale existují i jiné podobné reakce probíhající obdobnými mechanismy, například Tiffeneauův–Demjanovův přesmyk. Tyto „semipinakolové přesmyky“ probíhají za mírnějších podmínek a jsou tak vhodnější pro syntézy složitějších struktur.[7]
Reakce tohoto druhu mají význam i mimo samotná rozšiřování kruhů, protože atakované exocyklické skupiny mívají na sebe navázané i jiné než odstupující skupiny. Skupiny, ke kterým se přesunují endocyklické vazby, lze selektivně navázat na kruhy podle již napojených skupin, například 1,2-adicí na cyklické ketony.
Otevírání bicyklických molekul
editovatK rozšiřování kruhů se často využívá otevírání bicyklických meziproduktů obsahujících cyklopropanové cykly. Tyto reakce začínají Simmonsovou-Smithovou cyklopropanací cyklických alkenů.[8]
Podobným otevíráním kruhu založeným na cyklopropanech je Buchnerovo rozšiřování kruhů, ve kterém se přeměňují areny na cykloheptatrieny. Buchnerovo rozšiřování vytváří požadovaný produkt otevíráním s využitím navázání skupiny odtahující elektrony na přidávaný uhlík.
Otevírání kruhů jako součást rozšiřování je možné použít také na větší systémy; příkladem může být Grobova fragmentace. Podobně jako pinakolová migrace je Grobova fragmentace založená na skupinách dodávajících elektrony, které spouštějí přesuny vazby a ulehčují oddělení odstupujících skupin. Skupina dodávající elektrony může být pseudodonorem, který dodává elektronový pár na uhlík za současného štěpení vazby. Dowdovo–Beckwithovo rozšiřování kruhů dokáže také dodat na kruh více uhlíků zároveň, a je vhodným nástrojem pro vytváření velkých kruhů.[9] Tato reakce probíhá přes bicyklický meziprodukt, přičemž otevírání kruhu a cyklizace jsou součástmi stejné radikálové reakce.[10] Její pomocí lze rozšiřovat beta-ketoestery na ketony s velkými kruhy.
Navazování heteroatomů
editovatHeteroatomy lze do kruhů zapojovat také reakcemi rozšiřujícími kruhy.[11] Tyto reakce často probíhají migračními/inserčními mechanismy podobnými výše uvedeným reakcím napojujícím uhlík. Využití mají například u navazování dusíku Beckmannovým přesmykem při syntéze kodeinu[12] a v Baeyerových-Villigerových oxidacích (kde se navazuje kyslík a vznikají cyklické ethery).[13] Při obou těchto reakcích se odstupující skupina odděluje během přesunu alkylu na exocyklický heteroatom, čímž se podobají pinakolovým přesmykům.
Zmenšování kruhů
editovatReakcemi zmenšujícími kruhy se získávají kruhy s větším úhlovým napětím, pokud se takto tvoří snadněji než přímými cyklizacemi, nebo je původní větší kruh dostupnější.[14]
Reakce zmenšující kruhy mají své reaktivní meziprodukty, které zprostředkovávají zmenšení kruhu. Může jít o anionty, kationty, nebo karbenoidy.[15]
Favorského přesmyk
editovatMechanismus Favorského přesmyku zahrnuje atak karboaniontu na endocyklickém uhlíku a oddělení odstupující skupiny (v tomto případě halogenidu) za vzniku bicyklické molekuly s kruhy menšími než měla původní. Bicyklický meziprodukt je poté otevírán nukleofilním atakem na ketonu, čímž vznikne konečný produkt.[16] Touto reakcí lze převádět cyklohexanony na methylester kyseliny cyklopropankarboxylové.
Obdobou běžného Favorského přesmyku je reakce, kterou lze považovat za negativní pinakolový přesmyk; při ní se vytvoří vazba mezi aniontovou skupinou a odstupující skupinou, která se poté oddělí.[15] Také byla popsána obdoba Favorského přesmyku, která nevyžaduje přidání nukleofilu.
Kationtové varianty
editovatZmenšování kruhů kationtovými přesmyky probíhají oddělením podstupující skupiny a přesunem endocyklické vazby na karbokation. Často se provádějí jako pinakolové přesmyky.[17] Podobně jako rozšiřování kruhu vyžadují k přenosům skupin přítomnost skupin dodávajících elektrony.
Zmenšování jednoho kruhu lze spojit se zvětšováním jiného a tím z bicyklických molekul se stejně velkými jádry vytvořit produkty, jejichž části mají různou velikost. Takto bylo vytvořeno několik složitých molekul.[18]
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Ring expansion and contraction na anglické Wikipedii.
- ↑ a b c E. J. Kantorowski; M. J. Kurth. Expansion to seven-membered rings. Tetrahedron. 2000, s. 4317-4353. Dostupné online. DOI 10.1016/S0040-4020(00)00218-0.
- ↑ Michael B. Smith; Jerry March. March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. [s.l.]: [s.n.], 2006. ISBN 9780470084960. S. 1588-1592.
- ↑ Michael B. Smith; Jerry March. March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. [s.l.]: [s.n.], 2006. ISBN 9780470084960. DOI 10.1002/0470084960. S. 1599.
- ↑ W. Kirmse. 100 Years of the Wolff Rearrangement. European Journal of Organic Chemistry. 2002, s. 2193. DOI 10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D.
- ↑ Thomas N. Wheeler; J. Meinwald. Formation and Photochemical Wolff Rearrangement of Cyclic α-Diazo Ketones: d-Norandrost-5-en-3β-ol-16-carboxylic Acids. Organic Syntheses. 1972, s. 53. DOI 10.15227/orgsyn.052.0053.
- ↑ M. A. Casadei; C. Calli; L. Mandolini. Ring-closure reactions. 22. Kinetics of cyclization of diethyl (.omega.-bromoalkyl)malonates in the range of 4- to 21-membered rings. Role of ring strain. Journal of the American Chemical Society. 1984, s. 1051-1056. DOI 10.1021/ja00316a039.
- ↑ L. Kurti; B. Czako. Strategic Applications of Named Reactions. [s.l.]: Elsevier, 2005. Dostupné online. ISBN 978-0-12-429785-2. S. 350.
- ↑ One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-One. Organic Syntheses. 1979, s. 113. DOI 10.15227/orgsyn.059.0113.
- ↑ J. Hierold; D. W. Lupton. Synthesis of Spirocyclic γ-Lactones by Cascade Beckwith–Dowd Ring Expansion/Cyclization. Organic Letters. 2012, s. 3412-3415. DOI 10.1021/ol301387t. PMID 22691029.
- ↑ Dowd, P.; Choi; S. C. Journal of the American Chemical Society 1987, 3493–3494
- ↑ John McMurry. Organic Chemistry 7th Ed.. [s.l.]: [s.n.], 2008. ISBN 978-0-495-11258-7. S. 945-946.
- ↑ J. D. White; P. Hrnciar; F. Stappenbeck. Asymmetric Total Synthesis of (+)-Codeine via Intramolecular Carbenoid Insertion. Journal of Organic Chemistry. 1999, s. 7871-7884. DOI 10.1021/jo990905z.
- ↑ A. P. Marchand; V. S. Kumar; H. K. Hariprakasha. Synthesis of Novel Cage Oxaheterocycles. Journal of Organic Chemistry. 2001, s. 2072-2077. DOI 10.1021/jo001611c. PMID 11300903.
- ↑ Silva, L.F. Tetrahedron 2002, 9137–9161
- ↑ a b Andrew Myers. Methods for Ring Contraction [online]. Harvard University Department of Chemistry and Chemical Biology [cit. 2014-11-30]. Dostupné v archivu pořízeném dne 2014-12-05.
- ↑ Smith, Michael B.; March, Jerry. March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. [s.l.]: [s.n.], 2006. ISBN 9780470084960. DOI 10.1002/0470084960. S. 1595–1596.
- ↑ Zhen-Lei Song; Chun-An Fan; Yong-Qiang Tu. Semipinacol Rearrangement in Natural Product Synthesis. Chemical Reviews. 2011, s. 7523-7556. DOI 10.1021/cr200055g. PMID 21851053.
- ↑ G. Büchi; W. Hofheinz; J. V. Paukstelis. Synthesis of (-)-aromadendrene and related sesquiterpenes. Journal of the American Chemical Society. 1969, s. 6473-6478. DOI 10.1021/ja01051a051.
Literatura
editovat- Redmore, D.; Gutsche, C.D. Carbocyclic Ring Expansion Reactions, Academic Press, NY, 1968