Wolffův přesmyk
Wolffův přesmyk je organická reakce, při které α-diazokarbonylové sloučeniny odštěpují molekulární dusík za současného 1,2-přesmyku a mění se tak na keteny, jež se dají následně převést nukleofilními reakcemi se slabě kyselými nukleofily (například vodou, alkoholy, nebo aminy) na deriváty karboxylových kyselin, případně [2+2] cykloadicemi na čtyřčlenné kruhy.[1] Objevil ji Ludwig Wolff v roce 1902.[2]
Mechanismus Wolffova přesmyku je předmětem sporů; žádný z navržených mechanismů sám dostatečně nevysvětluje průběh reakce. Nejčastěji se uvádí soustředěný a karbenový mechanismus; níže je popsán první z nich.[3] Wolffův přesmyk má široké využití, protože α-diazokarbonylové sloučeniny jsou snadno dostupné, ketenové meziprodukty mohou reagovat několika způsoby, a stereochemie přesunující se skupiny se zachovává.[3] K jeho omezením patří značná reaktivita α-diazokarbonylových sloučenin, která poskytuje široký rozsah možných vedlejších reakcí.[1]
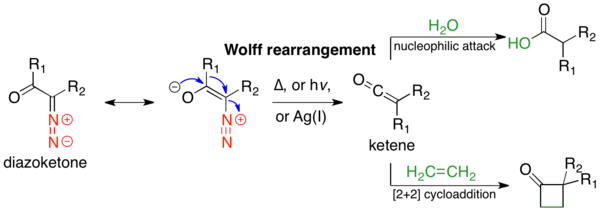
Wolffovy přesmyky lze vyvolávat termolyticky,[2] fotolyticky,[4] nebo katalyzátory založenými na přechodných kovech;[2] u přechodných kovů nejlépe fungují oxid stříbrný a další stříbrné sloučeniny. Wolffův přesmyk byl zahrnut do řady totálních syntéz.
Zvláštním případem je Arndtova–Eistertova reakce, kde se prodlužuje řetězec karboxylové kyseliny o methylenovou skupinu. Wolffovy přesmyky se využívají také ke zmenšování kruhů; jestliže je α-diazoketon cyklický, tak je kruh produktu Wolffova přesmyku menší než u výchozí látky. Wolffovy přesmyky lze také použít na tvorbu molekul obsahujících cykly s velkým kruhovým napětím, které se často nedají vytvořit jinými postupy.
Historie
editovatV roce 1902 zjistil Ludwig Wolff, že reakcí diazoacetofenonu s oxidem stříbrným a vodou vzniká kyselina fenyloctová a při nahrazení vody v reakční směsi amoniakem se tvoří fenylacetamid.[2] O několik let později byly v nezávislé studii dosaženy stejné výsledky.[5]
Využívání Wolffova přesmyku zaznamenalo rozvoj až 20 let po jeho objevu, protože do 30. let 20. století nebyla známa jednoduchá výroba diazoketonů.[3] Tato reakce byla poté zahrnuta do mnoha organických syntéz.[1][3]
Mechanismus
editovatMechanismus Wolffova přesmyku je předmětem sporů, často mezi soustředěným a postupným mechanismem;[3] na dvou parametrech ale panují shody. Zaprvé se α-diazokarbonylové sloučeniny vyskytují v rovnováze mezi s-cis a s-trans-konformery, jejichž zastoupení může ovlivnit průběh reakce; s-cis konformery při fotolýze reagují soustředěným mechanismem, jelikož jsou odstupující a přesunující se skupina vůči sobě v opačně rovnoběžné poloze, zatímco u s-trans molekul převažuje postupný karbenový mechanismus, případně nedochází k přesmyku. Druhým shodným prvkem je to, že nezávisle na mechanismu přesmyk vytváří keten, který lze zachytit slabě kyselým nukleofilem, například alkoholem nebo aminem, přičemž proběhne [2+2] cykloadice. Silné kyseliny nevyvolávají přesmyk, místo toho protonují α-uhlík a vyvolávají SN2 reakce.
Stereochemie α-diazo ketonů
editovatPro objasnění mechanismu Wolffova přesmyku je nutná stereochemie α-diazoketonů. Molekuly obsahující α-diazokarbonylové skupiny jsou v jejich místě zpravidla rovinné, jelikož mají vzhledem k dvojné povaze vazeb mezi karbonylovým a alfa uhlíkem velké rotační bariéry (55–65 kJ/mol).[6] Takto velké bariéry brání rotacím molekul a vedou k rovnováhám mezi dvojicí konformerů, s-trans a s-cis. s-cis-konformery jsou v důsledku elektrostatického přitahování mezi částečně záporným nábojem na kyslíku a kladně nabitým dusíkem elektronově výhodnější.[1] Když je skupina R1 velká a R2 je vodík, pak je stericky výhodnější s-cis, pokud jsou ale velké obě tyto skupiny, tak se stericky výhodnějším stává s-trans uspořádání; dostatečná velikost obou substituentů způsobí, že sterické odpuzování bude silnější než elektrostatické přitahování, což vede k převaze s-trans. Malé a středně velké cyklické molekuly zachovávají s-cis konformaci.
Soustředěný mechanismus
editovatKdyž je α-diazoketon v konformaci s-cis, tak jsou odstupující (N2) a přesunující se skupina (R1) navzájem opačně rovnoběžné, což upřednostňuje soustředěný mechanismus, ve kterém odštěpení dusíku probíhá současně s 1,2-přesmykem alkylu. Tento mechanismus se objevuje u termolytických i fotolytických variant reakce, kdy výrazně převažuje s-cis-konformer.[7]
Ve studii na základě chemicky indukované dynamické nukleární polarizace bylo zjištěno, že fotochemický přesmyk diazoacetonu, který se vyskytuje hlavně jako s-cis-konformer, probíhá soustředěně.[8]
Jako důkaz, že u s-cis-konformerů probíhá soustředěný a u s-trans-konformerů postupný mechanismus, byly použity poměry produktů přímé fotolýzy a fotolýzy zcitlivěné tripletovými stavy.[9]
Postupný mechanismus
editovats-trans-α-diazoketony nevykazují opačně rovnoběžné vzájemné uspořádání odstupující a přesunující se skupiny, takže je u nich pravděpodobný postupný přesmyk. Postupný mechanismus začíná odštěpením dusíku, které vede k tvorbě α-ketokarbenu. Tento α-ketokarben se může přeměnit 1,2-alkylovým přesmykem na keten, a nebo 4π-elektrocyklickou reakcí na antiaromatický oxiren. Opětovné otevření oxirenu může proběhnout dvěma způsoby, kde vzniká α-ketokarben, který může poté vytvoří konečný ketenový produkt.
Postupný mechanismus podporují dvě skutečnosti; zaprvé rychlostní konstanta Wolffových přesmyků závisí více na stabilitě vytvořeného karbenu než na náchylnosti přesunující se skupiny k přesunu[10] a za druhé je keten ochuzován o těžší izotopy, což odpovídá oxirenovému meziproduktu, který se vytváří pouze postupným mechanismem. Na obrázku níže je atom 13C zobrazen červeně. Symetrický oxirenový meziprodukt při otevírání ztrácí 13C label. Jestliže jsou skupiny R1 a R2 stejné, pak lze určit poměr produktů vznikajících soustředěným a postupným mechanismem; pokud se liší, oxiren se bude v jednom směru otevírat přednostně a poměr není možné zjistit, ale případné ochuzování o těžší izotop naznačuje postupnýmechanismus.[1]Během fotolýzy diazoacetaldehydu bylo odstraněno 8 % značek, což naznačuje, že se přes oxiren vytváří 16 % produktu.[11]
U fotolýzy bifenylového (R1 = R2 = fenyl) substátu byl pozorován přesun 20–30 % značek, takže se přes oxiren vytvářelo 40–60 % produktu;[12] u α-diazocyklohexanonu se podíl značky nesnižoval, protože tato látka je přítomna pouze jako s-cis izomer, a tak reaguje soustředěným mechanismem, při němž se oxiren nevytváří.[13]
Mechanistické studie
editovatZa termolytických i fotolytických podmínek probíhají jak soustředěný, tak i postupný mechanismus. Wolffův přesmyk byl předmětem mnoha mechanistických studií, zaměřujících se na konformace, zcitlivění, kinetiku, a ochuzování o izotopy; mezi těmito faktory ovlivňujícími zastoupení jednotlivých mechanismů lze určit obecně platná pravidla. α-diazoketony vyskytující se v s-cis konformaci zpravidla reagují soustředěným mechanismem, zatímco s-trans konformery vynucují postupný mechanismus.[1] Lépe se přesunující skupiny na α-diazoketonech podporují soustředěný mechanismus;[1] s výjimkou cyklických ale ty substráty, které vytváří výhradně s-cis izomer, reagují oběma způsoby.[1] Reakce řízené přechodnými kovy bývají různorodé, ale obecně probíhají přes karbenové meziprodukty.[3] Celý mechanismus fotolytického Wolffova přesmyku je přibližně znázorněn na tomto obrázku:
Přesuny skupin
editovatMechanismus Wolffova přesmyku ovlivňuje také to, jak snadno se příslušná skupina přesunuje; tuto schopnost lze určit pomocí mechanistické studie. Nejsnáze se přesunuje vodík, o něco pomalejší jsou přesuny alkylů a arylů (u alkylů jsou přesuny snazší při fotolýze a u arylů při termolýze).[14]
Vliv substituentů je u arylových skupin obvykle zanedbatelný, pouze areny s NO2 skupinami se přesunují o něco hůře.[14] Heterocykly bývají špatnými přesunujícími se skupinami, protože dodávají elektrony z p orbitalů do π* vazeb C=O, čímž snižují schopnost přesunu.[1]
Fotochemické reakce: H > alkyl ≥ aryl >> SR > OR ≥ NR2
Termolytické reakce H > aryl ≥ alkyl (heteroatomy se nepřesunují)
Příprava a výroba α-diazokarbonylových sloučenin
editovatWolffův přesmyk je znám od roku 1902, ale synteticky významným se stal ve 30 letech 20. století, kdy byly vyvinuty účinné postupy výroby α-diazokarbonylových sloučenin. Nejčastěji se používají Arndtův-Eistertův postup, Franzenova varianta Dakinovy-Westovy reakce, a diazotransfery.
Arndtova-Eistertova reakce
editovatArndtova–Eistertova reakce spočívá v acylaci diazomethanu acylchloridy, kdy vznikají převážně α-diazoketony. Uhlíkový konec diazomethanu se navazuje na karbonyl, za vzniku tetraedrického meziproduktu. Z tohoto meziproduktu se odštěpí chlorid, který poté deprotonuje meziprodukt na α-diazoketon.
α-diazoketony jsou nestálé v kyselých prostředích, kdy kyselina protonuje α-uhlík a chlorid může způsobit SN2 odštěpení dusíku.
Franzenova varianta Dakinovy-Westovy reakce
editovatDakinova–Westova reakce je reakce aminokyseliny s acylanhydridem za přítomnosti zásady, jejímiž produkty jsou ketoamidy. Franzenova varianta je vhodná na tvorbu α-diazoketonů.[15]
Franzenova varianta nitrosuje ketoamidy oxidem dusitým v kyselině octové a vzniklý produkt reaguje s methoxidem v methanolu za vzniku sekundárního α-diazoketonu.
Diazotransfery
editovatDiazotransfery spočívají v reakcích organických azidů, obvykle tosylazidu, s aktivovanými (dvojicí skupin odtahujících elektrony) methylenovými skupinami za přítomnosti zásady na α-diazo-1,3-diketony.[16]
Zásada deprotonuje methylen, čímž se utvoří enolát, který poté reaguje s tosylazidem. Produkt této reakce se následně rozkládá slabou kyselinou na α-diazo-1,3-diketon.
Potřeba dvou skupin odtahujících elektrony omezuje rozsah využití tohoto postupu; lze ale použít substráty obsahující jednu takovou skupinu, jestliže se nejprve formyluje keton Claisenovou kondenzací, po níž následuje diazotransfer a deformylace.[17]
Výhodou tohoto postupu je možnost použití nenasycených ketonů. Kinetické regioselektivity při tvorbě enoátu a lepší využitelnosti nenasycených karbonylových sloučenin lze dosáhnout vytvořením enolátu pomocí bis(trimethylsilyl)amidu lithného a nahrazení formylace trifluoracetylací.[18]
Způsoby spouštění přesmyku
editovatWolffovy přesmyky lze spustit termolyticky,[2] fotolyticky,[4] nebo katalyzátory založenými na přechodných kovech.[2]
Termolýza vyžaduje zahřívání reakční směsi na vysoké teploty, kolem 180 °C, a má tak jen omezené využití.[2] Mnohé produkty Wolffových přesmyků se vyznačují velkým kruhovým napětím a jejich kruhy se za vysokých teplot mohou otevírat. I za nižších teplot než přesmyky mohou navíc probíhat SN2 substituce diazoskupin na α-uhlících, které vytvářejí vedlejší produkty. Největší využití mají tepelné Wolffovy přesmyky při přípravách analogů karboxylových kyselin, kdy reagují keteny ve vysokovroucích rozpouštědlech, jako jsou anilin a fenol.[2]
Přechodné kovy umožňují provedení Wolffových přesmyků za nižších teplot, jelikož stabilizují komplexy typu kov-karben, tvořící se jako meziprodukty; ty jsou však někdy tak stálé, že se nepřesmykují. Karbeny rhodia, mědi, a palladia jsou na Wolffovy přesmyky příliš stálé a namísto nich vstupují do jiných reakcí, převážně karbenových insercí.[3] Nejvíce používaným katalyzátorem je zde oxid stříbrný, běžně se používá též benzoát stříbrný. Tyto reakce bývají uskutečňovány za přítomnosti slabých zásad, jako jsou uhličitan sodnýnebo terciární aminy.[3]
Tepelné a kovy katalyzované Wolffovy přesmyky jsou známé od roku 1902,[2] ale fotolytické varianty byly popsány až roku 1951.[4]Využívá se při nich skutečnost, že α-diazoketony mají dva absorpční pásy umožňující „povolené“ π→π* přechody o energiích odpovídajících 240–270 nm, a formálně „nepovolené“ π→σ* na 270–310 nm;[4] přechody elektronů v těchto oblastech mohou být vyvolány pomocí středně- a nízkotlakých rtuťových lamp. Tripletové sensitizátory způsobují vytváření karbenů neodpovídajících Wolffovým přesmykům, a nejsou tak pro jejich syntetická využití vhodné, byly však využity ke zkoumání jejich mechanismu.[3]
Syntetická využití
editovatWolffovy přesmyky mají, podle reakcí ketenových meziproduktů, několik možných retronů; například u Arndtových-Eisterových homologací jde o deriváty karboxylových kyselin obsahující α-methylenovou skupinu a u zmenšování kruhů je to kyselina, ke které patří α-uhlík v kruhu.
Homologační reakce
editovatArndtovy-Eistertovy homologatce přeměňují karboxylové kyseliny s chloridem thionylu ma acylchloridy, které poté reagují s diazomethanem nebo jinými diazoalkyly v Arndtových-Eistertových reakcích za vzniku α-diazoketonů, které je možné Wolffovými přesmyky (fotolytickými nebo katalyzovanými kovy) přeměnit na keteny.
V nejjednodušším případě, kdy R2= H a RXH=H2O, reakce prodlužuje alkylový řetězec karboxylové skupiny o methylenovou jednotku; změnou diazoalkylu a kyseliny Skupina R1 se přesouvá se zachováním konfigurace.[3] Arndtovou-Eistertovou homologací lze také vytvořit homologovaný aldehyd zachycením ketenu N-methylanilinem a redukcí hydridem lithnohlinitým, nebo zachycením ketenu ethanthiolem a redukcí s využitím Raneyova niklu.[19][20]
Celkem jsou popsány stovky Arndtových-Eistertových homologací,[21] zařazeny byly do řady totálních syntéz přírodních látek, například (−)-indolizidinu a (+)-makbecinu,[22][23] a (+)-salvileukalinu B.[24]
Zmenšování kruhů
editovatPokud se jako reaktant použije cyklický α-diazoketon, tak bude produkt Wolffova přesmyku obsahovat o jeden atom uhlíku méně. Tyto reakce probíhají soustředěným mechanismem, protože výchozí látky mívají s-cis konformaci, a fotokatalyticky. Níže je znázorněna odpovídající reakce α-diazocyklohexanonu, následovaná zachycením ketenu slabě kyselým nukleofilem.
První zmenšování kruhu Wolffovým přesmykem bylo pozorováno u α-diazokafru, kdy následnou kinetickou hydratací ketenu ze stericky dostupnější endo strany vznikala kyselina exo-1,5,5-trimethylbikyclo[2.1.1]hexan-6-karboxylová.[25]
Zmenšování kruhu je možné použít k tvorbě sloučenin s velkým kruhovým napětím; velikost kruhu nemá na Wolffův přesmyk vliv, ale často vyvolává další reakce. Je popsáno několik využití Wolffova přesmyku k přeměně cyklopentanonů na cyklobutany[26] a cyklobutanonů na cyklopropany.[27] Přeměny cyklohexanonů na cyklopentany se provádějí méně často, protože se dají uskutečnit Favorského přesmyky a Wolffův prekurzor se často obtížně připravuje;[3] příkladem syntézy, do které byla taková reakce zahrnuta, může být příprava (±)-∆9(12)-kapnelenu.[28]
Wolffův přesmyk lze také použít na tvorbu bicyklických sloučenin a propojených kruhů.
Cykloadice
editovatKeteny získané Wolffovými přesmyky mohou vstupovat do mezimolekulárních i vnitromolekulárních [2+2] cykloadičních reakcí s alkeny za vzniku čtyřčlenných kruhů.[29][30][31]
Keteny se mohou účastnit jinak „zakázaných“ [2+2] cykloadicí, protože jsou antarafaciální, díky čemuž Woodwardova–Hoffmannova pravidla dovolují [πs2 + πa2] cykloadice.[30] [2+2] cykloadiční reakce ketenů mohou být, v důsledku vedlejších reakcí, obtížné a vykazovat malé výtěžky. Vysokoenergetické aldoketeny jsou velmi reaktivní a cyklizují se s diazoketony za vzniku butenolidů a pyrazolů.[3]
[2+2] cykloadice ketenů byly zahrnuty do řady totálních syntéz, například u prostaglandinů.[29] Robert Ireland při syntéze (±)-afidikolinu použil Wolffův přesmyk k tandemu zkracování kruhu a [2+2] cykloadice.[32]
Danheiserova benzanelace fotolyzuje α-diazoketony a produkty zachytává pomocí alkynů, čímž vzniká posloupnost pericyklických reakcí, které vytvářejí substituované fenoly.[33] Prvním krokem je fotolýza α-diazoketonu za tvorby vinylketenu. Vinylketen poté v [2+2] cykloadici reaguje s alkynem a vytváří 2-vinylcyklobutenon, jenž poté prochází 4π-elektrocyklickým otevíráním kruhu, kterým vzniká dienylketen. Dienylketen pak vstupuje do 6π-elektrocyklického uzavírání kruhu, po němž následuje tautomerizace vytvářející konečný produkt.
Vinylogní Wolffovy přesmyky
editovatPři vinylogních Wolffových přesmycích se používají β,γ-nenasycené diazoketony a dochází u nich k 1,3-přesunu skupin CH2CO2R. Produkty jsou deriváty γ,δ-nenasycených karboxylových kyselin.
Tato varianta byla objevena na základě zjištění, že termolýzou 1-diazo-3,3,3-triarylpropan-2-onů vznikaly neočekávané izomerní produkty.[34]
Vinylogní Wolffovy přesmyky katalyzují zejména měďnaté a rhodnaté soli, nejčastěji se používají CuSO4 a Rh2(OAc)4.[35]
Tyto soli usnadňují tvorbu karbenu, které se mohou navázat na alkeny za vzniku cyklopropanů, jež je možné otevřít prostřednictvím retro [2+2] reakcí a vytvořit tím formálně 1,3-posunuté keteny, které po zachycení nukleofily tvoří vinylogní Wolfovy produkty.[36]
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Wolff rearrangement na anglické Wikipedii.
- ↑ a b c d e f g h i W. Kirmse. 100 Years of the Wolff Rearrangement. European Journal of Organic Chemistry. 2002, s. 2193. DOI 10.1002/1099-0690(200207)2002:14<2193::AID-EJOC2193>3.0.CO;2-D.
- ↑ a b c d e f g h i L. Wolff. Ueber Diazoanhydride. Justus Liebig's Annalen der Chemie. 1902, s. 129–195. Dostupné online. DOI 10.1002/jlac.19023250202.
- ↑ a b c d e f g h i j k l Gill, G. B. (1991) The Wolff Rearrangement. Trost, B. M. Flemming, I. (eds.) Comprehensive Organic Synthesis Oxford: Pergamon. 3:887 DOI:10.1016/B978-0-08-052349-1.00085-8 ISBN 978-0-08-052349-1
- ↑ a b c d L. Horner; E. Spietschka; A. W. Gross. Zur Kenntnis der Umlagerungsvorgänge bei Diazo-ketonen, o-Chinondiaziden und Säureaziden. Justus Liebig's Annalen der Chemie. 1951, s. 17–30. DOI 10.1002/jlac.19515730103.
- ↑ G. Schroeter. Über die Hofmann-Curtiussche, die Beckmannsche und die Benzilsäure-Umlagerung. Berichte der Deutschen Chemischen Gesellschaft. 1909, s. 2236–2249. Dostupné online. DOI 10.1002/cber.190904202131.
- ↑ C. Pecile; F. Foffani; S. Chersetti. The interaction of diazocarbonyl compounds with hydroxylic solvents. Tetrahedron. 1964, s. 823–829. DOI 10.1016/S0040-4020(01)98414-5.
- ↑ F. Kaplan; G. K. Meloy. The Structure of Diazoketones. A Study of Hindered Internal Rotation 1,2. Journal of the American Chemical Society. 1966, s. 950–956. DOI 10.1021/ja00957a017.
- ↑ H. D. Roth; M. L. Manion. Solution photochemistry of diazoacetone. Wolff rearrangement and acetylmethylene. Journal of the American Chemical Society. 1976, s. 3392–3393. DOI 10.1021/ja00427a067.
- ↑ H. Tomioka; H. Okuno; S. Kondo; Y. Izawa. Direct evidence for ketocarbene-ketocarbene interconversion. Journal of the American Chemical Society. 1980, s. 7123–7125. DOI 10.1021/ja00543a050.
- ↑ M. W. Regitz. Untersuchungen an Diazoverbindungen, VII. Vergleichende kinetische Untersuchungen zur thermischen Stabilität aliphatischer Diazoverbindungen. Chemische Berichte. 1970, s. 1477–1485. DOI 10.1002/cber.19701030519.
- ↑ K. P. Zeller. Zur formylcarben-oxiren-isomerisierung. Tetrahedron Letters. 1977, s. 707–708. DOI 10.1016/S0040-4039(01)92732-7.
- ↑ K. P. Zeller; H. Meier; H. Kolshorn; E. Mueller. Zum Mechanismus der Wolff-Umlagerung. Chemische Berichte. 1972, s. 1875–1886. DOI 10.1016/S0040-4039(01)92732-7.
- ↑ U. Timm; K. P. Zeller; H. Meier. Photolyse von 2-oxo-[2-13c]-1-diazocyclohexan. Ein beitrag zum oxiren-problem. Tetrahedron. 1977, s. 453–455. DOI 10.1016/0040-4020(77)80104-X.
- ↑ a b K. P. Zeller; H. Meier; E. Müller. Untersuchungen zur Wolff-Umlagerung—II. Tetrahedron. 1972, s. 5831–5838. DOI 10.1016/S0040-4020(01)88926-2.
- ↑ V. Franzen. Eine neue Methode zur Darstellung α,β-ungesättiger Ketone. Zerfall der Diazoketone R—CO—CN2—CH2—R′. Justus Liebigs Annalen der Chemie. 1957, s. 199. DOI 10.1002/jlac.19576020116.
- ↑ M. Regitz; A. Liedhegener. Reaktionen aktiver Methylenverbindungen mit Aziden, XII. Synthese von Diacyl-diazomethanen durch Diazogruppen-Übertragung. Chemische Berichte. 1966, s. 3128–3147. DOI 10.1002/cber.19660991010.
- ↑ M. Regitz. Reaktionen CH-aktiver Verbindungen mit Aziden, XVIII. Synthese von 2-Oxo-1-diazo-cycloalkanen durch entformylierende Diazogruppen-Übertragung. Chemische Berichte. 1968, s. 1263–1270. DOI 10.1002/cber.19681010419.
- ↑ R. L. Danheiser; R. F. Miller; R. G. Brisbois; S. Z. Park. An improved method for the synthesis of .alpha.-diazo ketones. The Journal of Organic Chemistry. 1990, s. 1959. DOI 10.1021/jo00293a053.
- ↑ F. Weygand; H. J. Bestmann. Neuere präparative Methoden der organischen Chemie III. Synthesen unter Verwendung von Diazoketonen. Angewandte Chemie. 1960, s. 535–554. DOI 10.1002/ange.19600721602. Bibcode 1960AngCh..72..535W.
- ↑ F. Weygand; H. J. Bestmann. Homologe Aldehyde aus Carbonsäuren. Chemische Berichte. 1959, s. 528–529. DOI 10.1002/cber.19590920303.
- ↑ Y. Tao; M. A. McKervey. Organic Synthesis with .alpha.-Diazo Carbonyl Compounds. Chemical Reviews. 1994, s. 1091–1160. DOI 10.1021/cr00028a010.
- ↑ C. W. Jefford; Q. Tang; A. Zaslona. Short, enantiogenic syntheses of (−)-indolizidine 167B and (+)-monomorine. Journal of the American Chemical Society. 1991, s. 3513–3518. DOI 10.1021/ja00009a043.
- ↑ D. A. Evans; S. J. Miller; M. D. Ennis. Asymmetric synthesis of the benzoquinoid ansamycin antitumor antibiotics: Total synthesis of (+)-macbecin. The Journal of Organic Chemistry. 1993, s. 471–485. DOI 10.1021/jo00054a035.
- ↑ S. Levin; R. R. Nani; S. E. Reisman. Enantioselective total synthesis of (+)-salvileucalin B. Journal of the American Chemical Society. 2011, s. 774–776. Dostupné online. DOI 10.1021/ja110192b. PMID 21174417.
- ↑ L. Horner; E. Spietschka. Über Lichtreaktionen IV1): Bicyclo-[1.1.2]-hexan-Derivate als Ergebnis der Umlagerung des Diazocamphers im Licht. Chemische Berichte. 1955, s. 934–939. DOI 10.1002/cber.19550880705.
- ↑ G. Lowe; D. D. Ridley. Synthesis of ?-lactams by photolytic Wolff rearrangement. Journal of the Chemical Society, Chemical Communications. 1973, s. 328–329. DOI 10.1039/c39730000328. PMID 4799188.
- ↑ K. Ueda; F. Toda. Wolff Rearrangement of 2-Diazo-3,4-Bis(Diphenylmethylene)Cyclobutmone into 1,2-Bis (Diphenylmethylene) Cyclopropmes. Chemical Letters. 1975, s. 779–780. DOI 10.1246/cl.1975.779.
- ↑ M. Ihara; T. Suzuki; M. Katogi; N. Taniguchi; K. Fukumoto. A stereoselective total synthesis of (±)-Δ9(12)-capnellene via the intramolecular Diels–Alder approach. Journal of the Chemical Society, Chemical Communications. 1991, s. 646–647. DOI 10.1039/c39910000646.
- ↑ a b E. J. Arnold Corey; J. Z. Hutton. Total synthesis of prostaglandins E2 and F2α () via a tricarbocyclic intermediate. Tetrahedron Letters. 1970, s. 307–310. DOI 10.1016/S0040-4039(00)61815-4. PMID 5414677.
- ↑ a b T. DoMinh; O. P. Strausz. Cycloaddition of ethoxyketene to olefins. Journal of the American Chemical Society. 1970, s. 1766–1768. DOI 10.1021/ja00709a062.
- ↑ D. Becker; D. Birnbaum. Intramolecular photoaddition of ketenes to conjugated cycloalkenones. The Journal of Organic Chemistry. 1980, s. 570–578. DOI 10.1021/jo01292a004.
- ↑ R. E. Ireland; W. C. Dow; J. D. Godfrey; S. Thaisrivongs. Total synthesis of (.+-.)-aphidicolin and (.+-.)-.beta.-chamigrene. The Journal of Organic Chemistry. 1984, s. 1001–1013. DOI 10.1021/jo00180a010.
- ↑ R. K. Danheiser; R. G. Brisbois; J. J. Kowalczyk; R. F. Miller. An annulation method for the synthesis of highly substituted polycyclic aromatic and heteroaromatic compounds. Journal of the American Chemical Society. 1990, s. 3093–3100. DOI 10.1021/ja00164a033.
- ↑ A. L. Wilds; J. van den Berghe; C. H. Winestock; R. L. von Trebra; N. F. Woolsey. Abnormal Acids from the Arndt-Eistert Synthesis. Journal of the American Chemical Society. 1962, s. 1503–1504. DOI 10.1021/ja00867a044.
- ↑ A. B. Smith; B. H. Toder; S. J. Branca. Vinylogous Wolff rearrangement. 4. General reaction of .beta.,.gamma.-unsaturated .alpha.'-diazo ketones. Journal of the American Chemical Society. 1984, s. 3995–4001. DOI 10.1021/ja00326a018.
- ↑ H. E. Zimmerman; R. D. Little. Mechanistic and exploratory organic photochemistry. LXXXVII. Photochemical rearrangement of 4-aryl-substituted cyclopentenones. Low-temperature photochemistry and direct observation of reaction intermediates. Journal of the American Chemical Society. 1974, s. 4623–4630. DOI 10.1021/ja00821a044.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Wolffův přesmyk na Wikimedia Commons