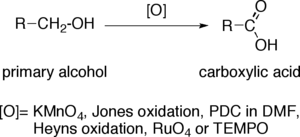
Oxidace primárních alkoholů na karboxylové kyseliny
Oxidace primárních alkoholů na karboxylové kyseliny jsou důležitou skupinou redoxních reakcí v organické chemii.
Při přeměně primárního alkoholu na karboxylovou kyselinu se oxidační číslo koncového atomu uhlíku zvýší o 4. U složitějších molekul, obsahujících další skupiny náchylné k oxidaci, je často možné provést i selektivní oxidace. Jako oxidační činidla se nejčastěji používají manganistan draselný (KMnO4) a okyselený roztok dichromanu draselného. Lze také použít Jonesovo činidlo, chlorchroman pyridinia v dimethylformamidu, oxid rutheničelý, TEMPO nebo Heynsovu oxidaci.
Manganistan draselný
editovatManganistan draselný (KMnO4) je silným oxidačním činidlem, reagujícím s mnoha funkčními skupinami, jako jsou i sekundární alkoholy, 1,2-dioly, aldehydy, alkeny, oximy, thioethery a thioly. Oxidace primárních alkoholů na karboxylové kyseliny pomocí KMnO4 jsou velmi účinné. Tato reakce, kterou poprvé podrobně popsal H. M. Fournier,[1][2] se obvykle provádí přidáním KMnO4 do zalkalizovaného vodného roztoku (nebo suspenze) alkoholu. Vytvořená směs se míchá, dokud není oxidace dokončena. K dobrému průběhu reakce je nutné, aby byl alkohol alespoň částečně rozpuštěn, toho lze dosáhnout například dodáním organického rozpouštědla, jako jsou dioxan, pyridin, aceton a terc-butanol. U nenasycených alkoholů bude KMnO4 nejprve reagovat s dvojnou vazbou uhlík-uhlík a až poté proběhne oxidace alkoholu.
Tyto oxidace obvykle probíhají v silně zásaditém prostředí, kde jsou rychlejší a selektivnější. U substrátů citlivých na silné zásady je možné použít nižší pH, dokonce i kyselé prostředí - reakce ovšem bude pomalejší.
KMnO4 se ve vodě rozkládá na oxid manganičitý (MnO2) a plynný kyslík. Tento proces může katalyzovat zásada, kyselina nebo MnO2. Vzhledem k tomuto rozkladu je třeba udržovat dostatečnou koncentraci KMnO4 jeho postupným přidáváním, dokud reakce probíhá.
Jonesova oxidace
editovatJonesovo činidlo se připravuje rozpuštěním oxidu chromového (CrO3) v kyselině sírové, čímž se vytvoří červený roztok obsahující kyselinu chromovou (H2CrO4) a její oligomery. Přidání tohoto činidla k acetonovému roztoku primárního alkoholu způsobí oxidaci alkoholu na karboxylovou kyselinu.[4][5]
Tento postup, obsahující přímou adici, je používán často, přestože mnohdy vede ke vzniku esterových vedlejších produktů (se strukturou R-CO-O-CH2-R) oxidační dimerizací primárních alkoholů. B. C. Holland a N. W. Gilman zjistili, že tyto vedlejší reakce lze výrazně omezit obrácenou adicí, kdy se roztok alkoholu v acetonu pomalu přidává k Jonesovu činidlu.[6]
Jonesovo činidlo může také oxidovat sekundární alkoholy na ketony. Ze sloučenin obsahujících primární i sekundární alkoholové skupiny vznikají ketokyseliny.
Potíže způsobované používáním velkých množství toxického oxidu chromového vedly k nalezení katalytického procesu spočívajícího v reakci kyseliny jodisté (H5IO6) za přítomnosti přibližně 1,2 mol% CrO3.[7] Použití katalytického množství CrO3 je obzvláště vhodné pro reakce prováděné ve velkém měřítku.[8]
Dichroman pyridinia v dimethylformamidu
editovatDichroman pyridinia (PDC) je světle oranžová pevná látka se vzorcem (C5H5NH)2Cr2O7, používaná na oxidace primárních alkoholů na aldehydy a sekundárních na ketony. Reakcemi nasycených primárních alkoholů s PDC lze však také získat karboxylové kyseliny, pokud se jako rozpouštědlo použije dimethylformamid (Me2NCHO, DMF).[10] U allylových a benzylových primárních alkoholů se tímto postupem karboxylové kyseliny nevytvářejí. Uvedený druh oxidace se provádí v neutrálním prostředí.
Heynsova oxidace
editovatV Heynsových oxidacích je oxidačním činidlem kyslík a katalyzátorem platina.
Oxid rutheničelý
editovatOxid rutheničelý je silným oxidačním činidlem a reakce tak mohou probíhat za mírných podmínek.
Dvoukroková oxidace přes aldehydy
editovatVzhledem k tomu, že řada oxidací alkoholů na karboxylové kyseliny probíhá za tvrdých podmínek a nelze při nich používat běžné chránicí skupiny, tak se často používají dvoukrokové oxidace.
Primární alkohol se nejprve zoxiduje na aldehyd, například pomocí kyseliny 2-jodoxybenzoové nebo Dessova–Martinova perjodinanu. Aldehyd se poté Pinnickovou oxidací za působení chloritanu sodného přemění na karboxylovou kyselinu.[11]
Tento postup bývá zahrnován do příprav přírodních látek, například platencinu.[12]
Odkazy
editovatReference
editovatV tomto článku byl použit překlad textu z článku Oxidation of primary alcohols to carboxylic acids na anglické Wikipedii.
- ↑ H. M. Fournier. Transformation des alcools primaires saturès en acides monobasiques correspondants. Comptes rendus de l'Académie des Sciences. 1907, s. 331. DOI 10.1002/cber.19430760510.
- ↑ H. M. Fournier. Sur la préparation des acides gras et de leurs anhydre. Bulletin de la Société Chimique de France. 1909-07-20, s. 920. Dostupné online.
- ↑ M. A. Ciufolini; S. Swaminathan. Synthesis of a model depsipeptide segment of Luzopeptins (BBM 928), potent antitumor and antiretroviral antibiotics. Tetrahedron Letters. 1989, s. 3027. DOI 10.1016/S0040-4039(00)99393-6.
- ↑ I. Heilbron; E .R. H. Jones; F. Sondheimer. 315. Researches on acetylenic compounds. Part XIV. A study of the reactions of the readily available ethynyl-ethylenic alcohol, pent-2-en-4-yn-1-ol. Journal of the Chemical Society. 1947, s. 1586. DOI 10.1039/jr9470001586.
- ↑ I. Heilbron; E .R. H. Jones. 129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols. Journal of the Chemical Society. 1949, s. 604. DOI 10.1039/jr9490000604.
- ↑ B. C. Holland; N. W. Gilman. An Improved Procedure for the Oxidation of Alkynols to Alkynoic Acids. Synthetic Communications. 1974, s. 203. DOI 10.1080/00397917408062073.
- ↑ M. Zhao; J. Li; Z. Song; R. Desmond; D. M. Tschaen; E. J. J. Grabowski; P. J. Reider. A novel chromium trioxide catalyzed oxidation of primary alcohols to the carboxylic acids. Tetrahedron Letters. 1998, s. 5323. DOI 10.1016/S0040-4039(98)00987-3.
- ↑ Z. J. Song, M. Zhao, R. Desmond, P. Devine, D. M. Tschaen, R. Tillyer, L. Frey, R. Heid, F. Xu, B. Foster, J. Li, R. Reamer, R. Volante, E. J. J. Grabowski, U. H. Dolling, P. J. Reider. Practical Asymmetric Synthesis of an Endothelin Receptor Antagonist. The Journal of Organic Chemistry. 1999, s. 9658. DOI 10.1021/jo991292t.
- ↑ M. T. Crimmins; A. C. DeBaillie. Enantioselective Total Synthesis of Bistramide A. Journal of the American Chemical Society. 2006, s. 5323. DOI 10.1021/ja057686l. PMID 16608311.
- ↑ E. J. Corey; G. Schmidt. Useful procedures for the oxidation of alcohols involving pyridinium dichromate in aprotic media. Tetrahedron Letters. 1979, s. 399. DOI 10.1016/S0040-4039(01)93515-4.
- ↑ B.S. Bal; W. E. Childers; H. W. Pinnick. Oxidation of α,β-unsaturated aldehydes. Tetrahedron. 1981, s. 2091. DOI 10.1016/S0040-4020(01)97963-3.
- ↑ K. C. Nicolaou; G. Scott Tria; D. J. Edmonds. Total Synthesis of Platencin. Angewandte Chemie. 2008, s. 1804. DOI 10.1002/ange.200800066.
Literatura
editovat- Marcos Fernández; Gabriel Tojo. Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis). Berlin: Springer, 2006. ISBN 0-387-35431-X.