Trinitrotoluen
Trinitrotoluen (často označovaný jako TNT nebo tritol, chemicky názvem 2,4,6-trinitrotoluen) je velmi silná, relativně bezpečná a hojně používaná trhavina.
| Trinitrotoluen | |
|---|---|
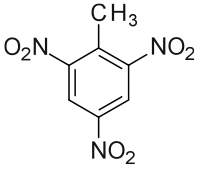 Strukturní vzorec trinitrotoluenu | |
 | |
| Obecné | |
| Systematický název | 2-methyl-1,3,5-trinitrobenzen |
| Triviální název | trinitrotoluen |
| Ostatní názvy | 2,4,6-trinitrotoluen, tritol, TNT |
| Anglický název | Trinitrotoluene |
| Německý název | Trinitrotoluol |
| Funkční vzorec | C6H2(NO2)3CH3 |
| Sumární vzorec | C7H5N3O6 |
| Vzhled | světle žlutá tuhá látka |
| Identifikace | |
| Registrační číslo CAS | 118-96-7 |
| EC-no (EINECS/ELINCS/NLP) | 204-289-6 |
| Indexové číslo | 609-008-00-4 |
| PubChem | 11763 |
| UN kód | 0209 |
| SMILES | O=[N+]([O-])c1c(c(ccc1C)[N+] ([O-])=O)[N+]([O-])=O |
| InChI | InChI=1/C7H5N3O6/c1-4-2-3-5(8(11)12) 7(10(15)16)6(4)9(13)14/h2-3H,1H3 |
| Vlastnosti | |
| Molární hmotnost | 227,131 g/mol |
| Teplota tání | 80,7 °C |
| Teplota rozkladu | 295 °C |
| Hustota | 1,663 g/cm3 |
| Rozpustnost ve vodě | 0,13 g/l (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H201 H331 H311 H301 H373 H411 |
| R-věty | R2 R23/24/25 R33 R51/53 |
| S-věty | (S1/2) S35 S45 S61 |
Některá data mohou pocházet z datové položky. | |
Historie
editovatPoprvé jej připravil roku 1863 německý chemik Julius Wilbrand[2] a původně se používal jako žluté barvivo. Jeho výbušný potenciál nebyl řadu let doceněn, zejména proto, že bylo tak obtížné jej odpálit a že byl o zlomek méně účinný než jiné výbušniny. Je-li v tekutém stavu, lze TNT plnit do dělostřeleckých granátů. V tekutém stavu je citlivost TNT oproti pevnému TNT větší, nikoliv však výrazně. [3] V pevném stavu je citlivost TNT nízká a je obtížné jej iniciovat, proto byl v roce 1910 vyřazen z britského oficiálního seznamu výbušnin.[4]
Německé ozbrojené síly začaly TNT používat jako náplně dělostřeleckých granátů v roce 1902. Protipancéřové granáty plněné TNT vybuchovaly až poté, co prorazily pancéřování britských bojových plavidel, zatímco britské granáty plněné lydditem vybuchovaly často již při nárazu na pancíř, čímž vydaly většinu energie mimo loď.[4] Britové začali nahrazovat lyddit trinitrotoluenem až v roce 1907.
Americké námořnictvo dál používalo granáty plněné dunnitem (pikrát amonný) i poté, co jiné národy přešly na TNT, ale začaly trinitrotoluenem plnit námořní miny, hlubinné pumy a hlavice torpéd.[5]
Základní fyzikální a chemické vlastnosti
editovatChemicky je TNT aromatický uhlovodík toluen, jehož 3 uhlíkové atomy aromatického jádra nesou namísto vodíkového atomu nitroskupinu (-NO2), funkční chemický vzorec této sloučeniny je C6H2(NO2)3CH3.
Je to nažloutlá krystalická látka o hustotě 1,663 g/cm3 a teplotě tání 80,7 °C. Lze jej snadno bezpečně roztavit a vzniklá kapalina má teplotu varu 210–212 °C. Jako pevná látka se chová pouze do teploty 35 °C, při zvýšení teploty se postupně stává plastickou a může proto docházet i k vytékání ze střeliva.
Ve vodě je prakticky nerozpustný, dobře se však rozpouští ve většině běžných organických rozpouštědel kromě ethanolu a sirouhlíku. Je zajímavé, že je velmi dobře rozpustný v kyselině sírové, vůči níž je stálý až do teplot nad 150 °C. Působením bazických sloučenin však přechází do nestabilních forem, (tzv. trytololáty), které se vyznačují velmi snadnou výbušností. Při manipulaci s TNT je proto nutno zabezpečit, aby se nedostal do styku s alkalickými látkami za zvýšené teploty.
Pyrotechnické vlastnosti a využití
editovatJako výbušnina vykazuje mimořádně dobré vlastnosti – je velmi stabilní a málo citlivá vůči vnějším vlivům a přitom se vyznačuje velmi vysokou brizancí a razancí výbuchu. Je proto ideální látkou pro přípravu jak průmyslových tak vojenských trhavin. Často se přitom v různém poměru mísí s jinými explozivními látkami a setkáme se s ním mimo jiné pod obchodním názvem Permonit, Permonex, Karpatit, známé jsou i vojensky využívané Amatoly a řada dalších.
Vzhledem k tomu, že jeho explozivní vlastnosti jsou velmi dobře prozkoumány, uvádí se pro vyjádření síly jaderného nebo termojaderného výbuchu ekvivalentní množství TNT v kilotunách (kt) či megatunách (Mt). Toto je ovšem zavádějící, neboť množství TNT nad 100 tun jsou schopna výrazného sekundárního zapálení sazí vzniklých po výbuchu, to znamená že 100 tun TNT má reálně ekvivalent uvolněné energie jako 130 tunových náloží (např).
Jak již bylo zmíněno, typickou vlastností výbuchu TNT je tvorba mraku sazí po explozi v důsledku relativně nízké a záporné kyslíkové bilance. Díky tomu se ale i malá množství chovají jako slabá termobarická výbušnina, např. 200 g TNT může mít při detonaci reálný vývin energie jako 225 g (tedy oproti teoretické hodnotě 8,2 MJ vznikne rapidně kolem 9 MJ energie TNT. Proto TNT překvapivě generuje i v malých množstvích tlakové vlny srovnatelné se Semtexem, ačkoliv naivně by se dala očekávat 20 % výhoda Semtexu (toto však závisí na dané studii a některé vykazují impulzy tlakové vlny konzistentní s nulovou rychlou oxidací sazí).
1 kg TNT má 50% úmrtnost v důsledku tlakové vlny ve vzdálenosti kolem 1,4 m (vzdálenost mezi náloží a horní polovinou těla, bez ohledu na orientaci osoby). 4,5 kg má na vzdálenost 2,5 m úmrtnost kolem 99 %. Avšak ani při použití 10 kg není smrtelná zóna větší než přibližně 4-5 m. Moderní 155mm granáty obsahují necelých 11 kg TNT, 60mm minometný granát má kolem 200 g a rozšířené ruční granáty kolem 100 g. V běžných bombách se 30-70 % energie spotřebuje na fragmentaci a nikoliv na generování tlakové vlny. Tlaková vlna tedy obecně není vhodným účinným mechanismem likvidace živé síly a tak hlavním cílem TNT je urychlování střepin.
Základní vlastnosti výbušniny
editovat- Energie výbuchu: 4 100 – 4 220 kJ/kg, tj. 980–1010 kcal/kg (bez sekundární oxidace sazí)
- Detonační rychlost: 6 900 m/s
- Objem spalných plynů: 730 l/kg
- Teplota exploze: 3 100 °C
- Specifické spalné teplo: 4,184 MJ/kg
- Detonační tlak Pcj : 190 - 220 kbar dle výpočetní nebo experimentální metody, obvykle u spodní hranice rozpětí
Výroba
editovatZákladem výroby je postupná nitrace aromatického uhlovodíku toluenu směsí kyseliny dusičné a kyseliny sírové. Zatímco nitrace do 2. stupně (směs různých izomerů dinitrotoluenů) probíhá za relativně mírných podmínek, je pro poslední nitrační stupeň nutno použít značně drastických reakčních podmínek – nitrace probíhá obvykle ve 20% oleu (roztok oxidu sírového v koncentrované kyselině sírové) za teplot kolem 80 °C.
Během přípravy TNT přitom vzniká pestrá směs různých vedlejších produktů a pro docílení kvalitního produktu je třeba co nejlépe izolovat právě požadovaný 2,4,6-trinitromethylbenzen. Způsob jak toho docílit s minimálními výrobními náklady, maximálním reakčním výtěžkem a co největším bezpečím pro obsluhující personál je předmětem pečlivě chráněných výrobních tajemství každé firmy, zabývající se průmyslovou výrobou této užitečné výbušniny.
Bezpečnost
editovatTNT je jedovatý, styk s kůží může vyvolat její podráždění a zbarvení do žlutooranžova. Během první světové války se pracovnicím nakládajícím s TNT při výrobě munice zbarvovala kůže do jasné žluté, proto získaly přezdívku „kanárkové dívky“ nebo jednoduše „kanárci“.
Lidé vystaveni po delší čas expozici TNT mohou trpět anémií nebo poruchami funkce jater. Účinky na krev a játra, zvětšování sleziny a další škodlivé účinky na imunitní systém se objevily také u zvířat, která požila nebo vdechovala TNT. Je prokázáno, že TNT nepříznivě ovlivňuje reprodukční schopnosti u mužů. TNT je také uveden na seznamu možných karcinogenů.[6] Konzumace TNT vyvolává červené zbarvení moči. Nikoli ovšem kvůli přítomnosti krve, jak je občas chybně uváděno, ale kvůli zbarvení produktů rozkladu TNT. [7] Dlouhodobá expozice způsobuje zákaly čočky v ekvatoriální oblasti (konsekutivní katarakta). Je uznávána jako nemoc z povolání.[8]
Některé vojenské zkušební oblasti jsou kontaminovány TNT. Odpadní vody z výroby munice, kontaminované povrchy a podpovrchové vody mohou být vzhledem k přítomnosti TNT zbarveny do růžova. Odstranění takové kontaminace, zvané též „růžová voda“, je obtížné a drahé.
TNT je relativně necitlivý na náraz, statickou elektřinu, tření a zvýšenou teplotu. Běžné údery kladivem, běžné elektrostatické výboje a obvyklé tření ho nedetonují. Ani malá množství TNT po zapálení (bez pevného obalu) nedetonují.
TNT je náchylný k vylučování dinitrotoluenů a dalších látek. Tento efekt mohou vyvolat i malá množství takových nečistot. Projevuje se zvláště u střel s obsahem TNT uložených při vyšších teplotách, např. v létě. Vylučování nečistot vede k tvorbě pórů a prasklin, které mohou vést ke zvýšení citlivosti na náraz. Migrací takto vyloučené kapaliny k zapalovači vznikají ohňové kanály, které zvyšují riziko náhodné detonace; kvůli těmto kapalinám může také selhat zapalovač.[9]
Reference
editovatV tomto článku byl použit překlad textu z článku Trinitrotoluene na anglické Wikipedii.
- ↑ a b 2,4,6-Trinitrotoluene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Wilbrand, J. Notiz über Trinitrotoluol. Annalen der Chemie und Pharmacie. 1863, s. 178–179. Dostupné online. DOI 10.1002/jlac.18631280206.
- ↑ http://bcpw.bg.pw.edu.pl/Content/3747/bulletin_de_lacademie_polonaise_des_sciences_1958_nr10_s617.pdf
- ↑ a b Brown GI. The Big Bang: a History of Explosives. [s.l.]: Sutton Publishing, 1998. Dostupné online. ISBN 0-7509-1878-0. S. 151–153.
- ↑ Fairfield AP. Naval Ordnance. [s.l.]: Lord Baltimore Press, 1921. S. 49–52.
- ↑ Toxicological Profile for 2,4,6-Trinitrotoluene
- ↑ 2,4,6-Trinitrotoluene [online]. Agency for Toxic Substances and Disease Registry [cit. 2010-05-17]. Dostupné online.
- ↑ KRUSE, A. Trinitrotoluene (TNT)-induced Cataract in Danish Arms Factory Workers. Acta Ophthalmol Scand. Roč. 2005, čís. 1, s. 26–30.
- ↑ The chemistry of explosives
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Trinitrotoluen na Wikimedia Commons



