Telomera
Telomery jsou koncové části chromozomů. Při buněčném dělení se telomery zkracují kvůli neschopnosti enzymu syntetizovat konce lineárních nukleových kyselin. Původní délka se obnovuje obvykle během tvorby pohlavních buněk činností enzymu telomerázy, což je neobvyklá RNA-dependentní DNA polymeráza nesoucí si vlastní molekulu RNA jako templát pro tvorbu DNA. Kromě pohlavních buněk jsou své telomery schopné znovu prodlužovat i kmenové buňky díky přítomnosti vlastní telomerázy. Většina rakovinných buněk také obnovuje své telomery pomocí telomerázy, což umožňuje potlačit růst řady rakovinných buněk blokací telomerázy,[1] část rakovinných buněk ale opravuje své telomery alternativním systémem využívajícím rekombinaci.[2]
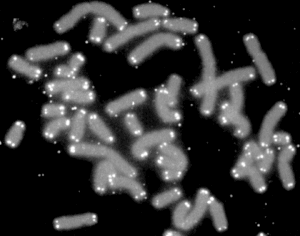
Telomery (z řečtiny – telos (τέλος) „zakončení“ – merοs (μέρος, kořen: μερ-) „část“) jsou umístěné na konci ramen chromozómu tvořeného chromatinem, kdy tyto konce jsou tvořené konstituvním chromatinem, který je repetetivního charakteru. Tvorba těchto opakujících se sekvencí je základ obranného mechanismu a také v oblasti centromery v chromozomu se nachází podobné, opakující se segmenty GGAAT. Postupné zkracování délky telomer vede ke stárnutí buňky (senescence) a její programované buněčné smrti vyvolané tumor supresorovými geny p53 a Rb, čímž je zabráněno nekontrolovatelnému buněčnému dělení.[3] Stárnutí s tím však nemusí souviset.[4] Délka telomer neindikuje dobře délku dožitého věku lidí.[5]
Telomery fungují jako postradatelné nárazníky, které jsou postupně spotřebovávány při procesu dělení buněk. Jejich přítomnost chrání geny, jsou přednostně zkracovány místo nich, tudíž geny vychází z procesu nepoškozené. Samotné telomery jsou chráněné proteiny telosomy (Shelterin) a také RNA (TERRA), telomery mohou být obnoveny enzymem TERT (hTERT). V poslední době se diskutuje o umělých zásazích do sekvencí DNA jejich opravou. Nicméně zde je třeba brát také ohled na etiku a možné neuvážené následky.
Objev
editovatBarbara McClintocková je první ženou, která byla oceněna Nobelovou cenou za fyziologii a lékařství, a to v roce 1983.
Zabývala se cytogenetikou a pozorovala, jak se chromozomy postrádající konce stávají pomalejšími a „lepivými“. Z toho vyvodila hypotézu o existenci jedinečné struktury na vrcholech chromozomů udržujících stabilitu a výdrž.
V období po roce 1970 byl ruský teoretik Alexei Olovnikov, první, kdo rozpoznal, jak chromozomy nedokáží replikovat svá zakončení. Na základě tohoto pozorování a ve shodě s názorem Leonarda Hayflicka o limitované míře buněčného dělení, Olovnikov později navrhl: DNA sekvence jsou ztraceny pokaždé, co se buňka dělí až do té doby, kdy postupná ztráta dosáhne kritické úrovně, při které dělení buněk končí.
Mezi lety 1975–1977, pracující kolegyně na Yaleové univerzitě Elizabeth Blackburnová s Josephem G. Gallem, objevila neobvyklou podstatu telomer, s jejich jednoduchou opakující se DNA sekvencí, z které se vrcholy chromozomů skládají. Blackburnová, Carol W. Greiderová, a Jack Szostak jsou vědci odměnění Nobelovou cenou za Nobelovou cenou za fyziologii a lékařství za rok 2009 za objev, že jsou chromozomy chráněné přítomností telomer a objevení enzymu telomerázy.
Funkce a podstata
editovatTelomery jsou opakující se sekvence nukleotidu nacházející se na vrcholcích lineárních chromozómů většiny eukaryotických organismů. TTAGGG je sekvence opakujících se nukleotidů, základ telomer obratlovců.
Většina prokaryotních organismů má chromozomy kruhovité, spíše než lineární a neuzavřené. Nemají tedy přítomné v kruhovém chromozomu telomery.
Přítomnost telomer kompenzuje neucelenou polokonzervativní DNA replikaci na vrcholcích chromozomů. U telomer mnohobuněčných eukaryotických organismů se nevyskytuje báze uracil v nukleotidech, stejně jako u samotné DNA.
Funkce:
- Mechanická ochrana konců chromozomů
- Brání před rekombinací s jinými chromozomy
- Zamezení zkracování oblastí nesoucích geny
- Ochrana proti rakovině
| Skupiny | Organismy | Opakující se sekvence telomer (5´až 3´ke konci) |
|---|---|---|
| Obratlovci | Lidé, myši, Xenopus | TTAGGG |
| Vláknité houby | Neurospora crassa | TTAGGG |
| Slime moulds | Physarum, Didymium (Dictyostelium) | TTAGGG (AG(1-8)) |
| Bičivky (prvoci) | Trypanosoma, Crithidia (Euglenozoa) | TTAGGG |
| Nálevníci (prvoci) | Tetrahymena, Glaucoma | TTGGGG |
| Nálevníci (prvoci) | Paramecium | TTGGG(T/G) |
| Nálevníci (prvoci) | Oxytricha, Stylonychia, Euplotes | TTTTGGGG |
| Výtrusovci (prvoci) | Plasmodium | TTAGGG(T/C) |
| Rostliny | Arabidopsis thaliana | TTTAGGG |
| Rostliny | Cestrum elegans | TTTTTTAGGG |
| Rostliny | Allium | CTCGGTTATGGG |
| Zelené řasy | Chlamydomonas | TTTTAGGG |
| Hmyz | Bombyx mori | TTAGG |
| Hlístice | Ascaris lumbricoides | TTAGGC |
| Schizosaccharomyces pombe | Schizosaccharomyces pombe | TTAC(A)(C)G(1-8) |
| Kvasinky | Saccharomyces cerevisiae | TGTGGGTGTGGTG (z předlohy RNA) nebo G(2-3)(TG)(1-6)T (konsensus) |
| Kvasinky | Saccharomyces castellii | TCTGGGTG |
| Kvasinky | Candida glabrata | GGGGTCTGGGTGCTG |
| Kvasinky | Candida albicans | GGTGTACGGATGTCTAACTTCTT |
| Kvasinky | Candida tropicalis | GGTGTA[C/A]GGATGTCACGATCATT |
| Kvasinky | Candida maltosa | GGTGTACGGATGCAGACTCGCTT |
| Kvasinky | Candida guillermondii | GGTGTAC |
| Kvasinky | Candida pseudotropicalis | GGTGTACGGATTTGATTAGTTATGT |
| Kvasinky | Kluyveromyces lactis | GGTGTACGGATTTGATTAGGTATGT |
Ve většině prokaryotních organismech, jsou choromozomy cyklické a nemají zakončení, netrpí tedy předčasnou terminací replikace. Malá část bakteriálních chromozomů, jako jsou v Streptomyces, Agrobacterium, a Borrelia, jsou lineární a obsahují telomery velmi odlišné od telomer v chromozomech eukaryotních buněk, strukturou i funkcí. Známé struktury bakteriálních telomer svou podstatou napodobují formu vázání bílkovin na koncích lineárních chromozomů, nebo uzavřených tvarů připomínající sponky do vlasů, z jedno-vláknitých DNA na zakončeních lineárních chromozomů.
Při procesu replikace DNA, replikační enzymy u eukaryotické DNA (komplex s DNA polymerázou a bílkovinami) nemohou replikovat přítomné sekvence na zakončení chromozomů (nebo přesně vlákna chromatidy). Aby se tyto úseky (a na nich zaznamenané informace) při replikaci neztratily, následují po nich právě telomery, které se tak stávají důležité při úspěšném procesu dělení buněk. Pomáhají “zakrýt“ konce genových sekvencí, ale samy jsou od konce postupně ztráceny při replikacii DNA. V buňce je možné nalézt enzym telomerázu, který doplňuje opakující se nukleotidové sekvence na konce DNA. Telomeráza tedy obnovuje postradatelnou část telomer, zakrývající DNA.
Ve většině mnohobuněčných eukaryotických organismech je telomeráza aktivní jen u zárodečných buněk. Některé druhy kmenových buněk jako jsou embryonální kmenové buňky (ESC) a některé bílé krvinky. Telomerázu je možné znovu aktivovat a telomery navrátit do embryoninálního stádia přes somatické přesunutí buněčného jádra. Existují teorie, které považují stálé zkracování telomer jednotlivými procesy replikace v somatických buňkách za příčinu stárnutí a postupně slábnoucí obranné mechanismy těla proti rakovině. To, je protože telomery se chovají jako zpožďovací “pojistka“, eventuálně po čase odejde z provozu po určitém proběhnutém počtu dělení buněk a to má za výsledek následnou ztrátu vitálně důležitých genetických informací z chromozomu buňky do budoucích procesů dělení buněk.
Délka telomer se velmi liší v závislosti na skupině organismů. Od přibližně 300 základních párů v kvasinkách až po mnoho párů bází (kb) v lidských chromozomech. Často jsou složené z rozmezí bohatých na guanin – 6 – 8 základních opakujících se párů. Eukaryotické telomery mají typické zakončení s 3´ jedno-vláknovým DNA převislým úsekem, který je esenciální pro udržování a zakrývání konce chromozomů. Bylo identifikováno více proteinů vázajících se na jedno či dvou vláknové telomery DNA. Fungují, jak v udržování telomer, tak v jejich vlastnosti zakrývat důležité sekvence DNA. Telomery se formují do struktur velkých smyček nazývaných stuhy (kroužky) telomer, zkráceně T-loops. Jednovláknová DNA se svine do dlouhého kroužku, stabilizovaného proteiny spojujícími telomery. Na konci T-loop je jednovláknová sekvence telomery (DNA) udržována na oblast dvou-vláknové DNA a to za přítomnosti vlákna telomery narušujícího strukturu dvoušroubovice DNA. Také přerušuje párování bází na jednom z vláken. Tato celkem 3 vláknová struktura se nazývá D-loop, nebo také D-kroužek (displacement loop, existuje také R-loop pro RNA).
Zkracování telomer u lidí vede k senescenci replikace a postupně blokuje dělení buněk. Základní podstatou tohoto mechanismu, ale je prevence před genovou nestabilitou a vývojem rakoviny v buňkách lidského těla, které jsou již staré a limitují počet možných uskutečnění buněčného dělení. Nicméně zároveň zkrácené telomery narušují funkce imunitního systému, které navyšují náchylnost vzniku neřízené rakoviny. Když nastane, že jsou již úseky telomer příliš krátké, potenciálně se mohou rozvinout z jejich uzavřené struktury. Buňka následně zaznamená odkrytí zranitelné DNA jako již poškození a přestane růst, vstoupí do buněčného stáří, nebo nastartuje apoptosu (sebe destruktivní proces), což se odvíjí od genetického pozadí buňky (p53 status). Odkrytí telomery se také děje při fúzi chromozomů. Protože v normálních somatických buňkách je považováno za nemožné toto poškození napravit, tak se v buňkách rovnou spustí apoptóza. Většina nemocí spojených se stárnutím jsou spojovány s zkrácenými úseky telomer, nicméně spíše to souvisí se zpomalující se schopností buněk telomery obnovovat. Funkce orgánů se zhoršují, jak více a více buněk je v procesu apoptózy, či vstupují do buněčného stárnutí, ve výsledku to vede k selhání orgánové soustavy.
Komplex Shelterin
editovatBílkovinný komplex známý jako shelterin chrání zakončení samotných telomer od rozpoznání za neopravitelné vidlicovité úseky inhibicí homologní rekombinace (HR) a nehomologním spojováním zakončení (NHEJ). Na samém distálním konci telomery se nachází základ 300 bází o jednom vlákně, které formuje T-loop (T-kroužek). Tato smyčka je analogická k uzlu, který stabilizuje telomery, zabraňuje rozpoznání zakončení telomer jako otevřené narušené části pro mechanismus opravy DNA. Když se vyskytne spojování zakončení, které je nehomologní ho typu na koncích telomer, výsledkem nakonec je spojení chromozomální. Smyčka T-loop je dohromady sestavena několika proteiny, zaznamenanými například TRF1, TRF2, POT1, TIN1, a TIN2. Tento soubor je společně označován komplex Shelterin. U lidí je komplex Shelterin složen z 6 bílkovin identifikovaných jako TRF1, TRF2, TIN2, POT1, TPP1, a RAP1.
Zkrácení
editovatV průběhu procesu se poslední RNA primer připojí a s DNA polymerázou a RNA nukleázou a DNA ligázou v procesu konvertují RNA (primeru) na DNA na zapečetění mezer mezi Okazakiho fragmentem. Z důvodu pozměnění RNA na DNA, musí již být přítomné vlákno DNA před úsekem RNA primeru. To se děje na všech místech zaostávající části, neděje se to však na konci, kde je přichycen poslední RNA primer. Nakonec , je tato RNA zničena působením enzymu, který degraduje zbylou RNA v těsné blízkosti umístěné na DNA. Proto je část telomery ztracena při každém cyklickém procesu replikace na 5´konci zaostávající části dceřiného vlákna od původního vlákna. Studie s experimenty provedenými ve zkumavkách poukázali, že telomery jsou vysoce citlivé na oxidační stres. Je důkaz o zprostředkovaném poškození DNA oxidačním procesem, na který je poukazováno jako důležitý, determinant zkracování telomery. Zkracování telomer vlivem volných radikálů vysvětluje rozdíl mezi předpokládanou ztrátou koncového replikačního problémového segmentu (c. 20 bp) za dělení buněk a skutečného zkrácení telomer. Zkrácení telomer, které probíhá v rozmezí 50–100 bp, a to má mnohem větší dopad na délku telomer, než zkrácení koncovým replikačním problémem, segmentu. Některé studiu se zaměřili na interakce mezi přírůstkem antioxidantů a délkou telomer. V LIBCSP, studii rakoviny prsu na Long Islandu byl nalezen střední nárůstek rizika vzniku rakoviny prsu u žen s nejkratšími telomerami a nízkého doplňování Beta-karotenu. Dále vitamínu C a E, to dle autorů dokazuje, že určitá míra interakce rizika vzniku rakoviny prsu a s mechanismy při poškozování DNA, souvisí s přítomností zkrácených telomer, způsobené oxidačním stresem. Zkracování telomer je často spojováno s procesy stárnutí a nemocemi stáří. V roce 2003 objevil Rochard Cawthon, dle jeho studie to, že jedinci s delšími telomerami vedou delší život, než jedinci s kratšími telomerami. Nicméně, není známo jestli krátké telomery jsou znakem stáří jednotlivé buňky, nebo se prakticky podílejí na stárnutí samém. Souvislost se střední délkou života se však prokázala u více druhů.[6]
Psychologický stres a zkracování telomer
editovatV roce 2017 proběhla meta-analýza 23 studií[zdroj?] a vyšla s výsledky, že zvýšené vnímání psychologického stresu bylo spojeno s malým poklesem délky telomer, zároveň byl ale také důkaz o potenciálním zkreslení při publikaci studií. Při vzetí zkreslení k výsledkům, se tento účinek zkrácení zmírnil a stal nevýznamným. Oxidační stres má trvat při zvýšeném množství volných radikálů.
Prodlužování
editovatLimit probíhajícího buněčné dělení byl poprvé předpokládán Leonardem Hayflickem (Stanfordova univerzita) a tato hranice je nyní nazývána Hayflick limit. V návaznosti na sebe byly učiněny signifikantní objevy skupinou vědců v organizaci Geron Corporation. Vedoucím výzkumníků byl zakladatel firmy Michael D. West, který definitivně propojil zkracování telomer s hranicí Hayflickova limitu. Klonování katalytických komponent telomerázy umožnilo testování experimentů, zda za dostatečné úrovně působení telomerázy a zamezením zkracování telomer, prodlouží životnost buněk. Účinky telomerázy byly publikované v časopise Science jako opravdu schopné prodloužení délky normálních funkcí buňky, nyní je na ní přihlíženo, že je schopna prodloužit životnost somatické buňky, zpomalováním zkracování telomer.
Reverze procesu zkracovaní telomer přes dočasnou aktivaci telomerázy může být praktickým způsobem zpomalení procesu stárnutí. Způsob jakým se to projevuje je oddálení Hayflickova limitu. Byly navrhnuty tři cesty na obrácení mechanismu zkracování telomer. Léky, genová terapie, nebo potlačení metabolismu tzv. strnulostí / hibernace. Tyto metody nebyly dosud prokázány na lidech, ale bylo demonstrováno, že zkracování telomer je zpomaleno až zastaveno během hibernace a stárnutí je během ni zpomaleno (Turbill, et al. 2012 & 2013). Hibernace by měla mít pozitivní vliv na délku života (Lyman et al. 1981). Úspěšně bylo prokázáno, že při reverzi zkracování telomer , došlo k úspěšnému zamezení některých znaků stárnutí, alespoň tedy u laboratorních myší. Dále také u hlístice (Caenorhabditis elegans). Je i hypotéza, že delší telomery a především aktivace telomerázy by mohla vést k urychlenému vývoji rakoviny (e.g. Weinstein and Ciszek, 2002). Nicméně delší telomery, jak již bylo zmíněno, mohou i chránit proti výskytu rakoviny, protože u příliš zkrácených telomer je pravděpodobnost výskytu rakoviny větší. Také bylo navrhnuto, že prodloužené telomery by mohly vést k zvýšené spotřebě energie organismem.
Metody na prodloužení telomer by mohly být využity i u manipulace s tkání, a to, že dovolují zdravé savčí buňky bez známky rakovinného bujení kultivovat v množství dostatečně velkém na biomedicínské inženýrství na opravy materiálu a tkání.
Dvě studie o dlouho žijících mořských ptácích demonstrovaly fakt, že role telomer není plně pochopena. V roce 2003 vědci pozorovali prodlužující se telomery během stárnutí u ptáka Oceanodroma leucorhoa. To bylo poprvé, co byl takový vývoj telomer vůbec zaznamenán. V roce 2006 bylo ohlášeno (Juola) objevení dalšího dlouho žijícího mořského ptáka s zkracujícími se telomerami do 40 roka života a to u Fregata minor. U tohoto nesouvisejícího druhu se po 40 roku života výrazně objevilo prodlužování telomer, nicméně se tetnto jev u každého jedince lišil. Navíc podle délky telomer nelze rozeznat věk jedince tohoto ptačího druhu. Z toho vědci vyvozují, že u procesů spojených s telomerami jsou variace v délce, s kterými ještě nejsou plně obeznámeni. Gilley a Blackburn testovali, zda zkracování telomer má vliv na buněčné stárnutí u trepek a došli k závěru, že při stárnutí nedocházelo k zkracování telomer.
Dále Gomes s kolegy vydal studii v komparativní biologii savčích telomer, ve které tvrdí že délka telomer různých savců koreluje nepřímo s délkou života a zůstává v tématu se stárnutím spíše kontroverzní. K tomu tým s Harrisem našel jen minimální důkazy na to, že by lidské telomery přímo vykazovaly vztah s procesem stárnutí, spíše než důležitost kognitivních schopností a fyzických schopností jedince.
Výzkum rizika onemocnění
editovatTelomery jsou kritické pro udržování genů nepoškozených, a integrovaných a mohou být faktorem silně ovlivňujícím startování nemocí spjatých s stárnutím. Studie laboratoří ukazují, že obecně dysfunkce a krácení telomer se objevuje během stárnutí a vývoje rakovinného neřízeného dělení. Krátké telomery mohou vést k nestabilitě genových sekvencí, ztrátě chromozomů, formací nerecipročním translacím. Telomery jsou rakovinných buňkách a v jejich lezích prekurzorů signifikantně kratší, než v okolní nezasažené tkáni. Pozorovací studie objevili ve velkém množství experimentů zkoumajících rakovinu, krátké telomery. Navíc u lidí s rakovinnými buňkami v těle byly objeveny kratší telomery v leukocytech zaručujících správný chod imunitní soustavy, tím ji také brzdící (narušující metabolismus), než u zdravých lidí. Nedávná meta-analýza navrhuje 1.4. až 3.0 násobně zvýšené riziko vývoje rakoviny pro ty, kteří mají kratší telomery, než u jedinců, kteří mají v buňkách přítomné telomery delší. Nicméně zvýšené riziko závisí i na věku, pohlaví, rozdíly v životním režimu a typu a místě rakovinného bujení v těle.
Měření
editovatJednou z metod je TRF (Terminal restriction fragment) jižní skvrny. Započetí polymerázového řetězce reakcí jako testovací metody zahrnuje determinaci, telomery na jednu genovou kopii v poměru (T/S), to je ukázkový segment, který odpovídá v buňce průměrné délce telomer. Zatímco více společností nabízí měření délky telomer, zacházení s těmito měřeními jsou široce diskutabilní pro využívání v medicíně i osobně pro jednotlivce. Elizabeth Blackburn (nositelka Nobelovy ceny), je spoluzakladatelkou jedné z těchto firem a podporuje využití měření délky telomer v klinickém prostředí.
Reference
editovat- ↑ PHILIPPI, C.; LORETZ, B.; SCHAEFER, UF.; LEHR, CM. Telomerase as an emerging target to fight cancer--opportunities and challenges for nanomedicine.. J Control Release. 2010, s. 228-40. DOI 10.1016/j.jconrel.2010.03.025. PMID 20381558.
- ↑ CONOMOS, D.; PICKETT, HA.; REDDEL, RR. Alternative lengthening of telomeres: remodeling the telomere architecture.. Front Oncol. 2013, s. 27. DOI 10.3389/fonc.2013.00027. PMID 23429284.
- ↑ CAMPISI, J. Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors.. Cell. 2005, s. 513-22. DOI 10.1016/j.cell.2005.02.003. PMID 15734683.
- ↑ https://www.geneticliteracyproject.org/2015/01/14/the-telomere-hype-how-to-debunk-claims-about-telomeres-and-aging/ - Telomere hype: How to debunk claims about telomeres and aging
- ↑ http://medicalxpress.com/news/2016-04-age-mobility-death-molecular-clock.html - Age and mobility predict death better than one's 'molecular clock'
- ↑ https://phys.org/news/2019-07-telomere-shortening-species-lifespan.html - Researchers discover that the rate of telomere shortening predicts species lifespan
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu telomera na Wikimedia Commons
- https://web.archive.org/web/20141006091440/http://petr-kufner.blog.cz/1103/telomery-a-telomerazy