Rambergova–Bäcklundova reakce
Rambergova–Bäcklundova reakce je organická reakce α-halogenovaných sulfonů za přítomnosti zásady, kdy se odštěpením oxidu siřičitého vytváří alkeny.[1] Objevili ji švédští chemici Ludwig Ramberg a Birger Bäcklund.
Reakce začíná deprotonací, která vytvoří karboanion, ten se přemění na nestálý episulfon, jehož rozkladem se uvolní oxid siřičitý a vznikne konečný produkt.

Při této reakci se mění vazba uhlík–síra na dvojnou vazbu uhlík–uhlík.
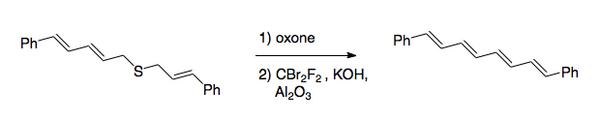
Původní provedení zahrnovalo halogenaci sulfidu, následovanou oxidací na sulfon. V novějším postupu se po oxidaci, obvykle prováděné peroxokyselinou, uskutečňuje halogenace dibromdifluormethanem v zásaditém prostředí.[2] Tímto způsobem byl připraven 1,8-difenylokta-1,3,5,7-tetraen.
Využití
editovatRambergova–Bäcklundova reakce má několik využití, může být například použita na tvorbu malých[3]
a velkých kruhů obsahujících dvojné vazby.[4]
Touto reakcí byl mimo jiné připraven 1,2-dimethylencyklohexan[5]
a přeměněny epoxidy na allylalkoholy.[6]
Rambergovu–Bäcklundovu reakci lze použít na přípravu C-glykosidů; potřebné thioethery se dají snadno vytvořit z thiolů a následná Rambergova–Bäcklundova reakce vytváří exocyklické vinylethery, jež je možné zredukovat na C-nukleosidy.[7]
Obměnou této reakce lze oxidací sulfamidů získat azosloučeniny.[8]
Substráty
editovatAlfa-halogenované sulfony potřebné pro tuto reakci lze získat oxidací α-halogensulfidů peroxokyselinami, například kyselinou m-chlorperoxobenzoovou; oxidace sulfidů se provádí za přítomnosti alkenů a alkoholů, kdy probíhá selektivně. Alfa-halogenované sulfidy mohou být získány ze sulfidů s využitím halogenovaných elektrofilů, jako je N-chlorsukcinimid nebo N-bromsukcinimid.[9]
Mechanismus
editovatSulfonová skupina má na jedné z poloh α kyselý vodík, který se odštěpí působením silné zásady. Takto vznikne karboanion, který se přesune na halogen navázaný na druhou polohu α, čímž se vytvoří tříčlenný cyklický sulfon. Tento meziprodukt je nestálý a uvolní oxid siřičitý za vzniku alkenu; obvykle přitom vznikají směsi cis a trans izomerů.[10]
Podobnými reakcemi jsou Favorského přesmyk a Eschenmoserova sulfidová kontrakce.
Reference
editovatV tomto článku byl použit překlad textu z článku Ramberg–Bäcklund reaction na anglické Wikipedii.
- ↑ Ludwig Ramberg; Birger Bäcklund. The reactions of some monohalogen derivatives of diethyl sulfone. Archives of Chemistry, Mineralogy and Geology. 1940, s. 1–50. ISSN 0365-3781.
- ↑ Tze-Lock Chan; Sun Fong; Yu Li; Tim-On Man; Chi-Duen Poon. A new one-flask Ramberg–Bäcklund reaction. Journal of the Chemical Society, Chemical Communications. 1994, s. 1771–1772. doi:10.1039/C39940001771.
- ↑ Leo A. Paquette; J. Christopher Philips; Robert E. Wingard. α-Halo sulfones. XVIII. Ramberg–Baecklund rearrangement as a synthetic entry to unsaturated propellanes. Journal of the American Chemical Society. 1971, s. 4516–4522. doi:10.1021/ja00747a029.
- ↑ D. I Magee; E. J. Beck. The use of the Ramberg–Bäcklund rearrangement for the formation of aza-macrocycles: a total synthesis of manzamine C. Canadian Journal of Chemistry. 2000, s. 1060–1066. doi:10.1139/v00-103.
- ↑ BLOCK, Eric; ASLAM, Mohammad. A General Synthetic Method for the Preparation of Conjugated Dienes From Olefins Using Bromomethanesulfonyl Bromide: 1,2-Dimethylenecyclohexane. Org. Synth.. 1987, s. 90. Dostupné online. doi:10.15227/orgsyn.065.0090.; Coll. Vol.. S. 212.
- ↑ P. Evans; P. Johnson; R. J. K. Taylor. The Epoxy-Ramberg–Bäcklund Reaction (ERBR): A Sulfone-Based Method for the Synthesis of Allylic Alcohols. European Journal of Organic Chemistry. 2006, s. 1740–1754. doi:10.1002/ejoc.200500956.
- ↑ F. K. Griffin; D. E. Paterson; P. V. Murphy; R. J. K. Taylor. ChemInform Abstract: A New Route to exo-Glycals Using the Ramberg–Baecklund Rearrangement. ChemInform. 2002, s. 1305. doi:10.1002/chin.200233219.
- ↑ OHME, R.; PREUSCHHOF, H.; HEYNE, H.-U. Azoethane. Org. Synth.. 1988. Dostupné online.; Coll. Vol.. S. 78.
- ↑ Horst Böhme; Heinz-Joachim Gran. Über die Einwirkung von Chlor auf Thioäther und Mercaptale. Justus Liebigs Annalen der Chemie. 1952-07-12, s. 68–77. doi:10.1002/jlac.19525770109.
- ↑ Leo A. Paquette. Organic Reactions. [s.l.]: [s.n.], 1977. ISBN 9780471264187. doi:10.1002/0471264180.or025.01. Kapitola The Ramberg–Bäcklund Rearrangement.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Rambergova–Bäcklundova reakce na Wikimedia Commons