Octan kobaltnatý
Octan kobaltnatý (též acetát kobaltnatý; systematický název ethanoát kobaltnatý) je organická látka, sůl kyseliny octové a kobaltu. Obvykle se vyskytuje ve formě tetrahydrátu jako Co(CH3COO)2·4 H2O, který je typický svou růžovou barvou.
| Octan kobaltnatý | |
|---|---|
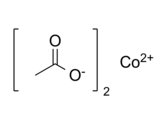 Strukturní vzorec | |
 Vzhled tetrahydrátu | |
| Obecné | |
| Systematický název | ethanoát kobaltnatý |
| Triviální název | octan kobaltnatý |
| Latinský název | cobaltum acetate |
| Anglický název | cobalt(II) acetate |
| Funkční vzorec | (CH3COO)2Co |
| Sumární vzorec | C4H6O4Co |
| Vzhled | rudý prášek růžový (tetrahydrát) |
| Identifikace | |
| Registrační číslo CAS | 71-48-7 6147-53-1 (tetrahydrát) |
| PubChem | 6277 |
| ChEBI | 85138 |
| UN kód | 3XC4P44U7E |
| SMILES | CC(=O)[O-].CC(=O)[O-].[Co+2] |
| InChI | InChI=1S/2C2H4O2.Co/c2*1-2(3)4;/h2*1H3,(H,3,4);/q;;+2/p-2 |
| Číslo RTECS | AG3150000 |
| Vlastnosti | |
| Molární hmotnost | 177,02 g/mol 249,08 g/mol (tetrahydrát) |
| Teplota tání | 140 °C (413 K) (tetrahydrát) |
| Teplota rozkladu | 298 °C |
| Teplota dehydratace | 140 °C (-4 H2O) (tetrahydrát) |
| Hustota | tetrahydrát 1,71 g/cm3 (20 °C/pevné skupenství) [1] |
| Index lomu | 1,542 (tetrahydrát) |
| Rozpustnost ve vodě | tetrahydrát 38 g/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech | 2,1 g/100 mg methanolu (15 °C) rozpustný v alkoholech, zředěných kyselinách |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v pyridinu, amylacetátu (tetrahydrát) |
| Tlak páry | zanedbatelný (20 °C) |
| Měrná magnetická susceptibilita | +11,000·10−6 μm3/g |
| Struktura | |
| Krystalová struktura | jednoklonná (tetrahydrát) |
| Bezpečnost | |
| Nebezpečí | |
| H-věty | H317, H334, H341, H350, H360, H400, H410 [2] |
| P-věty | P261, P272, P273, P280, P281, P284, P302+352, P304+340, P321, P333+313, P391, P405, P501 |
| NFPA 704 |  0
1
0
|
Některá data mohou pocházet z datové položky. | |
Vlastnosti
editovatOctan kobaltnatý je za standardní teploty tuhá, krystalická látka. Bezvodá forma má plně červené až rudé zabarvení, oproti tetrahydrátu, který je světle růžový.[2] Octan kobaltnatý má hygroskopické vlastnosti a při déle trvajícímu vystavení vzdušné vlhkosti se rozpouští v krystalové vodě. Látka zapáchá po octu.[2] Jsou známy různé varianty hydrátů této látky, např. Co(CH3COO)2· H2O či [Co(CH3COO)2]5·0.5 H2O.[3]
Příprava
editovatV laboratoři lze připravit například neutralizací hydroxidu kobaltnatého kyselinou octovou.
- CH3COOH + Co(OH)2 → Co(CH3COO)2 + H2O
Další možností výroby, která je používána v průmyslu je neutralizace uhličitanu kobaltnatého kyselinou octovou.
- CH3COOH + CoCO3 → Co(CH3COO)2 + CO2 + H2O
Zdravotní rizika
editovatU této látky, stejně jako u ostatních sloučenin kobaltu, je předpokládána karcinogenita pro člověka, poškození reprodukčních schopností a podezření z mutagenity.[4] Akutní toxicita u krysy při orálním podání byla stanovena na LD50 = 503 mg/kg, což řadí octan kobaltnatý dle WHO mezi látky slabě toxické. Při vdechnutí dochází k podráždění dýchacích cest. Požití způsobuje zvracení, bolesti břicha, bolest a slabost končetin a přítomnost krve ve zvratcích a stolici.[2]
Použití
editovatBezvodý octan kobaltnatý je v chemickém průmyslu především používán jako katalyzátor. Také je využíván jako prekurzor pro přípravu jiných materiálů, chemických komplexů, mazadel, inkoustů, barviv a v pokovovacích lázních.[5] V barvivech je používán ve formě katalyzátorů přidávaných do nátěrových barev, které urychlují proces zasychání a zrání aplikovaných barev.
Malá množství tetrahydrátu octanu kobaltnatého jsou někdy v chovu hospodářských zvířat přidávána do krmiv pro zlepšení zdravotního stavu dobytka, kde spolu s ostatními solemi kobaltu slouží ke zvýšenému příjmu vitamínu B12. Ten je z těchto solí tvořen v gastrointestinálním traktu především u přežvýkavců za pomoci symbiotických bakterií. Vzhledem k potenciální toxicitě kobaltu v potravinářských výrobcích z takto krmených zvířat, je použití solí kobaltu regulováno.[4]
Reference
editovat- ↑ Cobalt(II) Acetate Tetrahydrate [online]. AMERICAN ELEMENTS ® [cit. 2022-05-21]. Dostupné online. (anglicky)
- ↑ a b c d National Center for Biotechnology Information. Cobalt(II) acetate [online]. PubChem, 2005-07-19, rev. 2022-05-14 [cit. 2022-05-21]. Dostupné online. 6277. (anglicky)
- ↑ ZHANG, Gao; LIN, Jian; GUO, Dong-Wei; YAO, Shi-Yan; TIAN, Yun-Qi. Infinite Coordination Polymers of One- and Two-dimensional Cobalt Acetates. S. 1401–1404. Zeitschrift für anorganische und allgemeine Chemie [online]. Wiley Online Library, 2010 [cit. 2022-05-21]. S. 1401–1404. Dostupné online. ISSN 1521-3749. doi:10.1002/zaac.200900457. (anglicky)
- ↑ a b EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP) [online]. 7. vyd. Wiley Online Library: EFSA Journal, 2012 [cit. 2022-05-21]. (10). S. 2791. Dostupné online. doi:10.2903/j.efsa.2012.2791. (anglicky)
- ↑ Chemical Book. Cobalt acetate [online]. [cit. 2022-05-21]. Dostupné online.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Octan kobaltnatý na Wikimedia Commons


