Dekamethylferrocen
Dekamethylferrocen je organická sloučenina se vzorcem Fe(C5(CH3)5)2, zkráceně C20H30Fe. Jedná se o sendvičovou sloučeninu s železnatým kationtem (Fe2+) navázaným na dva pentamethylcyklopentadienylové anionty (Cp*−, (CH3)5C -
5 ). Lze jej také považovat za derivát ferrocenu, který má všechny atomy vodíku nahrazeny methylovými skupinami. Jeho vzorec se často zapisuje zkráceně jako DmFc[3], Me10Fc[4] nebo FeCp*2.[5]
| Dekamethylferrocen | |
|---|---|
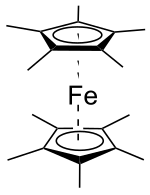 Strukturní vzorec | |
| Obecné | |
| Systematický název | dekamethylferrocen |
| Sumární vzorec | C20H30Fe |
| Vzhled | žlutá pevná látka[1] |
| Identifikace | |
| Registrační číslo CAS | 12126-50-0 |
| PubChem | 5148079 |
| SMILES | C[c-]1c(c(c(c1C)C)C)C.C[c-]1c(c(c(c1C)C)C)C.[Fe+2] |
| InChI | InChI=1S/2C10H15.Fe/c2*1-6-7(2)9(4)10(5)8(6)3;/h2*1-5H3;/q2*-1;+2 |
| Vlastnosti | |
| Molární hmotnost | 326,30 g/mol |
| Teplota tání | 291 až 295 °C (564 až 568 K) |
| Teplota sublimace | 140 °C (413 K) (5,3 Pa)[2] |
Některá data mohou pocházet z datové položky. | |
Tato žlutá pevná látka se používá v laboratořích jako slabé redukční činidlo. Železnaté jádro se snadno oxiduje na trojmocné železo za vzniku jednovazného dekamethylferroceniového kationtu, může však dosáhnout i vyšších oxidačních čísel.[5]
Příprava
editovatDekamethylferrocen se, obdobně jako ferrocen z cyklopentadienu, připravuje z pentamethylcyklopentadienu; takto lze získat i jiné dekamethylcyklopentadienylové sendvičové sloučeniny.[1]
- 2 Li(C5Me5) + FeCl2 → Fe(C5Me5)2 + 2 LiCl
Produkt může být přečištěn sublimací. Struktutra FeCp*2 je tvořena dvojicí překrývajících se Cp* kruhů. Průměrná vzdálenost Fe-C činí přibližně 205 pm. Tato struktura byla potvrzena na základě rentgenovou krystalografií.[6]
Redoxní reakce
editovatPodobně jako ferrocen vytváří i dekamethylferrocen stabilní kation, vznikající oxidací Fe2+ na Fe3+. V důsledku dodávání elektronů z methylových skupin na Cp* je silnějším redukčním činidlem než ferrocen. V acetonitrilových roztocích je redukční potenciál páru [FeCp*2]+/0 −0,59 V, zatímco u [FeCp2] má vzhledem k Fc/Fc+ v CH2Cl2 hodnotu −0,48 V.[2]
Dekamethylferrocen v kyselém prostředí redukuje kyslík na peroxid vodíku.[7]
Silnými oxidačními činidly, jako jsou fluorid antimoničný, fluorid arseničný a XeF+Sb2F -
11 v HF/SbF5, se dekamethylferrocen oxiduje na stabilní dikation obsahující železičité jádro. V soli Sb2F -
11 jsou Cp* kruhy rovnoběžné. U soli SbF -
6 jsou navzájem vychýlené o 17°.[5]
Reference
editovatV tomto článku byl použit překlad textu z článku Decamethylferrocene na anglické Wikipedii.
- ↑ a b R. B. King; M. B. Bisnette. Organometallic Chemistry of the Transition Metals XXI. Some π-pentamethylcyclopentadienyl Derivatives of Various Transition Metals. Journal of Organometallic Chemistry. 1967, s. 287–297. DOI 10.1016/S0022-328X(00)91042-8.
- ↑ a b N. Connelly; W. E. Geiger. Chemical Redox Agents for Organometallic Chemistry. Chemical Reviews. 1996, s. 877–910. DOI 10.1021/cr940053x. PMID 11848774.
- ↑ Angel A. J. Torriero. Characterization of decamethylferrocene and ferrocene in ionic liquids: argon and vacuum effect on their electrochemical properties. Electrochimica Acta. 2014, s. 235–244. DOI 10.1016/j.electacta.2014.06.005.
- ↑ Indra Noviandri; Kylie N. Brown; Douglas S. Fleming; Peter T. Gulyas; Peter A. Lay; Anthony F. Masters; Leonidas Phillips. The Decamethylferrocenium/Decamethylferrocene Redox Couple: A Superior Redox Standard to the Ferrocenium/Ferrocene Redox Couple for Studying Solvent Effects on the Thermodynamics of Electron Transfer. The Journal of Physical Chemistry B. 1999-08-01, s. 6713–6722. ISSN 1520-6106. DOI 10.1021/jp991381+.
- ↑ a b c M. Malischewski; M. Adelhardt; J. Sutter; K. Meyer; K. Seppelt. Isolation and structural and electronic characterization of salts of the decamethylferrocene dication. Science. 2016, s. 678–682. DOI 10.1126/science.aaf6362. Bibcode 2016Sci...353..678M.
- ↑ Derek P. Freyberg; John L. Robbins; Kenneth N. Raymond; James C. Smart. Crystal and molecular structures of decamethylmanganocene and decamethylferrocene. Static Jahn-Teller distortion in a metallocene. Journal of the American Chemical Society. 1979, s. 892–897. DOI 10.1021/ja00498a017.
- ↑ Bin Su; Imren Hatay; Pei Yu Ge; Manuel Mendez; Clemence Corminboeuf; Zdenek Samec. Oxygen and proton reduction by decamethylferrocene in non-aqueous acidic media. Chemical Communications. 2010, s. 2918–2919. Dostupné online. DOI 10.1039/B926963K. PMID 20386822.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Dekamethylferrocen na Wikimedia Commons