Bromoform
Bromoform je organickou sloučeninou bromu (patří mezi haloformy, tedy deriváty methanu, kde jsou tři atomy vodíku nahrazeny atomy téhož halogenu). Její systematický název je tribrommethan, vzorec CHBr3. Vzhledem to je bledě žlutá kapalina nasládlého zápachu. Je mírně rozpustná ve vodě a velmi snadno přechází do plynného skupenství. Jde o jedovatou a přírodě nebezpečnou látku.
| Bromoform | |
|---|---|
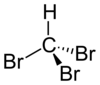 Strukturní vzorec | |
 Prostorový model | |
| Obecné | |
| Systematický název | tribrommethan |
| Triviální název | bromoform |
| Sumární vzorec | CHBr3 |
| Vzhled | bezbarvá až žlutá kapalina s nasládlým zápachem |
| Identifikace | |
| Registrační číslo CAS | 75-25-2 |
| EC-no (EINECS/ELINCS/NLP) | 200-854-6 |
| Indexové číslo | 602-007-00-X |
| Vlastnosti | |
| Molární hmotnost | 252,73 g/mol |
| Teplota tání | 8,0 °C |
| Teplota varu | 149 °C |
| Hustota | 2,889 g/cm3 |
| Rozpustnost ve vodě | 3,2 g/l (30 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H331 H302 H319 H315 H411 |
| R-věty | R22 R23 R36/38 R51/53 |
| S-věty | (S1/2) S28 S45 S61 S63 |
Některá data mohou pocházet z datové položky. | |
Malá množství této sloučeniny jsou vytvářena mořskými rostlinami. Nejvíc bromoformu se do okolí dostává jako vedlejší produkt reakce, při které je do vody ve vodárnách zaváděn chlór, který v ní ničí bakterie, a tím se tato voda stává pitnou.
Dnes se bromoform průmyslově nevyrábí v příliš velkém množství, jeho výroba uplatňovaná v průmyslu dnes už spíš pomalu zaniká.[zdroj?] Dříve se bromoform používal jako rozpouštědlo, dnes se však již nanejvýš užívá jako laboratorní činidlo.
V přírodě je bromoform produkován chaluhami jako jejich hlavní organohalogenová sloučenina, slouží jim k ochraně před bakteriemi a proti spásání.[2]
Reference
editovat- ↑ a b Bromoform. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ GRIBBLE, GW. The diversity of naturally produced organohalogens.. Chemosphere. Jul 2003, roč. 52, čís. 2, s. 289–97. Dostupné online. doi:10.1016/S0045-6535(03)00207-8. PMID 12738253.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Bromoform na Wikimedia Commons


