Allylchlorid
Allylchlorid je organická sloučenina, chlorovaný derivát propenu (patří tedy mezi halogenderiváty). Je prakticky nerozpustný ve vodě ale dobře rozpustný v běžných organických rozpouštědlech. Většinou se převádí na epichlorhydrin, který se používá ve výrobě plastů. Je to alkylační činidlo, což jej činí nebezpečným při skladování.
| Allylchlorid | |
|---|---|
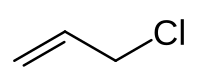 Strukturní vzorec | |
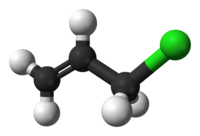 Tyčinkový model molekuly | |
 Kalotový model molekuly | |
| Obecné | |
| Systematický název | 3-chlorprop-1-en |
| Ostatní názvy | 3-chloropren |
| Anglický název | Allyl chloride |
| Sumární vzorec | C3H5Cl |
| Vzhled | bezbarvá, hnědá, žlutá či růžová kapalina |
| Identifikace | |
| Registrační číslo CAS | 107-05-1 |
| PubChem | 7850 |
| SMILES | C=CCCl |
| InChI | InChI=1S/C3H5Cl/c1-2-3-4/h2H,1,3H2 |
| Vlastnosti | |
| Molární hmotnost | 76,52 g/mol |
| Teplota tání | −135 °C (138 K) |
| Teplota varu | 45 °C (318 K) |
| Hustota | 0,94 g/cm3 |
| Index lomu | 1,4055 |
| Rozpustnost ve vodě | 0,36 g/100 ml (20 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a chloroformu |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a benzenu |
| Tlak páry | 39,3 kPa |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 R20/21/22 R36/37/38 R40 R48/20 R50 R68 |
| S-věty | S2 S16 S25 S26 S36/37 S46 S61 |
| Teplota vzplanutí | −32 °C (241 K) |
| Teplota vznícení | 390 °C (663 K) |
Některá data mohou pocházet z datové položky. | |
Výroba a příprava
editovatV laboratoři
editovatAllylchlorid poprvé připravili roku 1857 Auguste Cahours a August Hofmann reakcí allylalkoholu s chloridem fosforitým.[2][3] Moderní návody upřednostňují tento postup před poměrně drahým použitím chloridu fosforitého s kyselinou chlorovodíkovou a katalyzátorem, jako je například chlorid měďný.
V průmyslu
editovatAllylchlorid se vyrábí chlorací propenu. Při nižších teplotách vzniká 1,2-dichlorpropan, ovšem je-li teplota vyšší než 500 °C, převažuje allylchlorid, který se tvoří radikálovou reakcí:
- CH3CH=CH2 + Cl2 → ClCH2CH=CH2 + HCl
Tímto způsobem bylo v roce 1997 vyrobeno asi 800 000 tun allylchloridu.[3]
Použití
editovatVýrazná většina allylchloridu se převádí na epichlorhydrin.[3]
Jakožto alkylační činidlo se allylchlorid používá na výrobu léčiv a pesticidů jako je allylisothiokyanát.
Reakce
editovatJako ukázka reaktivity allylchloridu může posloužit jeho reakce s hořčíkem:
- 2 ClCH2CH=CH2 + Mg → (CH2)2(CH=CH2)2 + MgCl2
či kyanace na allylkyanid (CH2=CHCH2CN):
- 2 CH2=CHCH2Cl + KCN → CH2=CHCH2CN + KCl
Bezpečnost
editovatAllylchlorid je toxický a hořlavý. Pokud se dostane do očí, může způsobit zhoršení zraku.
Odkazy
editovatSouvisející články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu p-Aminopropiofenon na Wikimedia Commons
Reference
editovatV tomto článku byl použit překlad textu z článku Allyl chloride na anglické Wikipedii.
- ↑ a b Allyl chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Hofmann. Augustus William and Cahours. Augustus (1857) "Researches on a new class of alcohols," Philosophical Transactions of the Royal Society of London, 147: 555–574 ; see pp. 558–559.
- ↑ a b c Ludger Krähling, Jürgen Krey, Gerald Jakobson, Johann Grolig, Leopold Miksche “Allyl Compounds” in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. Published online: 15 June 2000.



