Acetylacetonát železitý
Acetylacetonát železitý, zkráceně Fe(acac)3, je železitý komplex s acetylacetonátovými (acac) ligandy, patřící mezi acetylacetonáty kovů. Jedná se o na vzduchu stálou červenou pevnou látku, rozpustnou v nepolárních organických rozpouštědlech.
| Acetylacetonát železitý | |
|---|---|
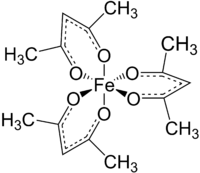 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | (Z)-4-oxopent-2-en-2-olát železitý |
| Sumární vzorec | C15H21FeO6 |
| Vzhled | červená pevná látka |
| Identifikace | |
| Registrační číslo CAS | 14024-18-1 |
| EC-no (EINECS/ELINCS/NLP) | 237-853-5 |
| PubChem | 139087805 |
| SMILES | Cc(c[c-](C)o1)o[Fe+3]123(oc(c[c-](C)o2)C)oc(c[c-](C)o3)C |
| InChI | InChI=1S/3C5H8O2.Fe/c3*1-4(6)3-5(2)7;/h3*3,6H,1-2H3;/q;;;+3/p-3/b3*4-3-; |
| Vlastnosti | |
| Molární hmotnost | 353,17 g/mol |
| Teplota tání | 180 až 181 °C (453 až 454 K) |
| Teplota varu | rozklad |
| Hustota | 1,348 g/cm3 |
| Rozpustnost ve vodě | 0,2 g/100 ml |
Některá data mohou pocházet z datové položky. | |
Příprava
editovatFe(acac)3 se připravuje reakcí právě vysráženého Fe(OH)3 s acetylacetonem.
- Fe(OH)3 + 3 HC5H7O2 → Fe(C5H7O2)3 + 3 H2O
Struktura a vlastnosti
editovatFe(acac)3 je oktaedrický komplex obsahující šest rovnocenných vazeb Fe-O o délkách kolem 200 pm. Pravidelná geometrie odpovídá vysokospinovému Fe3+ jádru. Protože všechny orbitaly kovu obsahují sudý počet elektronů, tak se u komplexu neprojevuje Jahnův–Tellerův efekt a jeho molekulová symetrie je typu D3. Podobná sloučenina Mn(acac)3 má oktaedrickou strukturu více deformovanou.[1] Pět nespárovaných d elektronů dodává komplexu paramagnetické vlastnosti, s magnetickým momentem 5,90 μB.
Fe(acac)3 má axiální chiralitu; Δ- a Λ-enantiomer se pomalu přeměňují jeden v druhý. Tyto přeměny probíhají dostatečně pomalu na to, aby bylo možné enantiomery od sebe částečně oddělit.[2]
Reakce
editovatFe(acac)3 může být použit jako reaktant a prekatalyzátor v organické chemii, přestože aktivní sloučeninu železa v těchto procesech obvykle nelze identifikovat. Fe(acac)3 je schopen spouštět křížové párovací reakce dienů vytvářející alkeny.[3]
Fe(acac)3 katalyzuje dimerizaci isoprenu na směs 1,5-dimethyl-cyklookta-1,5-dienu a 2,5-dimethyl-cyklookta-1,5-dienu.[4]
Fe(acac)3 se rovněž dá použít jako katalyzátor polymerizace 1,3-benzoxazinu.[5]
Fe(acac)3 je také možné zapojit do katalýzy reakcí N-sulfonyloxaziridinů s alkeny za vzniku 1,3-oxazolidinů.[6]
Odkazy
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Acetylacetonát železitý na Wikimedia Commons
Reference
editovatV tomto článku byl použit překlad textu z článku Tris(acetylacetonato)iron(III) na anglické Wikipedii.
- ↑ K. E. Lawson. The infrared absorption spectra of metal acetylacetonates. Spectrochimica Acta. 1961, s. 248–258. DOI 10.1016/0371-1951(61)80071-4.
- ↑ Anders Lennartson Optical resolution and racemisation of [Fe(acac)3] Inorganica Chimica Acta 2011, vol. 365, pp. 451–453 DOI:10.1016/j.ica.2010.07.066
- ↑ J. A. L. Takacs; G. V. Madhavan; M. Creswell; F. Seely; W. Devroy. Iron-Catalyzed Aminohydroxylation of Olefins. Organometallics. 1986, s. 2395–2398. DOI 10.1021/om00142a044.
- ↑ A. Misono. Oligomerization of isoprene by cobalt or iron complex catalysts. Bulletin of the Chemical Society of Japan. 1966, s. 2425–2429. DOI 10.1246/bcsj.39.2425.
- ↑ A. Sudo; Shoji Hirayama; Takeshi Endo. Highly efficient catalysts-acetylacetonato complexes of transition metals in the 4th period for ring-opening polymerization of 1,3-benzoxazine. Journal of Polymer Science Part A: Polymer Chemistry. 2010, s. 479. DOI 10.1002/pola.23810.
- ↑ K. T. Williamson; T. Yoon. Iron-Catalyzed Aminohydroxylation of Olefins. Journal of the American Chemical Society. 2010, s. 4570–4571. DOI 10.1021/ja1013536. PMID 20232850.