Ruthenistan tetrapropylamonný
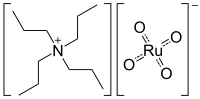
Ruthenistan tetrapropylamonný (zkráceně TPAP nebo TPAPR) je chemická sloučenina se vzorcem N(C3H7)4RuO4, používaná v organické syntéze. Jedná se o sůl tetrapropylamonného kationtu s ruthenistanovým aniontem, RuO -
4 .
| Ruthenistan tetrapropylamonný | |
|---|---|
 | |
| Obecné | |
| Systematický název | ruthenistan tetrapropylamonný |
| Funkční vzorec | (CH3CH2CH2)4N+RuO - 4 |
| Sumární vzorec | C12H28NRuO4 |
| Vzhled | zelená pevná látka |
| Identifikace | |
| Registrační číslo CAS | 114615-82-6 |
| PubChem | 127020979 |
| SMILES | CCC[N+](CCC)(CCC)CCC.O=[Ru](=O)([O-])=O |
| InChI | InChI=1/C12H28N.4O.Ru/c1-5-9-13(10-6-2,11-7-3)12-8-4;;;;;/h5-12H2,1-4H3;;;;;/q+1;;;;-1;/rC12H28N.O4Ru/c1-5-9-13(10-6-2,11-7-3)12-8-4;1-5(2,3)4/h5-12H2,1-4H3;/q+1;-1 |
| Vlastnosti | |
| Molární hmotnost | 351,43 g/mol |
| Teplota rozkladu | 160 °C (433 K) |
| Bezpečnost | |
| [1] | |
| H-věty | H272 H315 H319 H335[1] |
| P-věty | P210 P220 P221 P261 P264 P271 P280 P302+352 P304+340 P305+351+338 P312 P321 P332+313 P337+313 P362 P370+378 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Použití
editovatOxid rutheničelý je velmi silným oxidačním činidlem, TPAP, jeho jednoelektronově redukovaný derivát, je mírnější. Primární alkoholy oxiduje na aldehydy,[2] sekundární alkoholy se pak přeměňují na ketony.[3]
Při použití většího množství katalyzátoru a kooxidantu a přidání dvou ekvivalentů vody lze primární alkoholy oxidovat až na karboxylové kyseliny. V tomto případě se vytváří hydrát geminálního diolu, který se poté znovu oxiduje.[4]
Vodu vznikající při oxidaci je možné odstranit pomocí molekulárních sít. TPAP je nákladný, ovšem postačuje použití katalytických množství. Průběh katalytického cyklu zajišťuje stechiometrický kooxidant, jako například N-methylmorfolin-N-oxid[5] nebo molekulární kyslík.[6]
TPAP se také používá ke štěpení vicinálních diolů na aldehydy.[3]
Reference
editovatV tomto článku byl použit překlad textu z článku Tetrapropylammonium perruthenate na anglické Wikipedii.
- ↑ a b c https://pubchem.ncbi.nlm.nih.gov/compound/127020979
- ↑ Steven V. Ley; Joanne Norman; William P. Griffith; Stephen P. Marsden. Tetrapropylammonium perruthenate, Pr4N+RuO4−, TPAP: A catalytic oxidant for organic synthesis. Synthesis. 1994, s. 639–666. DOI 10.1055/s-1994-25538.
- ↑ a b Steven V. Ley; Joanne Norman; Anthony J. Wilson. Encyclopedia of Reagents for Organic Synthesis. doi.wiley.com. John Wiley & Sons, 2011. Dostupné online. ISBN 978-0-471-93623-7. DOI 10.1002/047084289x.rt074.pub2.
- ↑ Z. Xu; C. W. Johannes; A. F. Houri; D. S. La; D. A. Cogan; G. E. Hofilena; A. H. Hoveyda. Applications of Zr-catalyzed carbomagnesation and Mo-catalyzed macrocyclic ring closing metathesis in asymmetric synthesis. Enantioselective total synthesis of Sch 38516 (Fluvirucin B1). Journal of the American Chemical Society. 1997, s. 10302–10316. DOI 10.1021/ja972191k.
- ↑ William P. Griffith; Steven V. Ley; Gwynne P. Whitcombe; Andrew D. White. Preparation and use of tetra-n-butylammonium per-ruthenate (TBAP reagent) and tetra-n-propylammonium per-ruthenate (TPAP reagent) as new catalytic oxidants for alcohols. Journal of the Chemical Society, Chemical Communications. 1987, s. 1625–1627. DOI 10.1039/C39870001625.
- ↑ Roman Lenz; Steven V. Ley. Tetra-n-propylammonium perruthenate (TPAP)-catalysed oxidations of alcohols using molecular oxygen as a co-oxidant. Journal of the Chemical Society, Perkin Transactions. 1997, s. 3291–3292. DOI 10.1039/A707339I.
- ↑ John A. Hadfield; Alan T. McGown; John Butler. A high-yielding synthesis of the naturally occurring antitumour agent irisquinone. Molecules. 2000, s. 82–88. Dostupné online. DOI 10.3390/50100082.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Ruthenistan tetrapropylamonný na Wikimedia Commons

