Reimerova–Tiemannova reakce
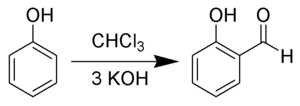
Reimerova–Tiemannova reakce je organická reakce používaná k o-formylaci fenolů za přítomnosti zásady;[1][2][3][4][5] nejjednodušší variantou je přeměna fenolu na salicylaldehyd. Objevili ji Karl Reimer a Ferdinand Tiemann.[6]
Mechanismus
editovatChloroform (1) je deprotonován silnou zásadou (obvykle hydroxidem) za vzniku chloroformového karboaniontu (2), který se ihned alfa-eliminací přemění na dichlorkarben (3). Deprotonován je také fenol (4), ze kterého se vytvoří fenoxidový anion (5). Záporný náboj je delokalizován po benzenovém kruhu, což vede ke zvýšené nukleofilitě. Reakcí tohoto aniontu s dichlorkarbenem vznikne dichlormethylsubstituovaný fenol (7), z něhož se po zásadité hydrolýze stane konečný produkt (9).[7]
Selektivita
editovatKarben (3) má díky dvěma atomům chloru, které odtahují elektrony, nízkou elektronovou hustotu a snadno tak reaguje s fenoxidem (5), který ji má vysokou. Díky tomu probíhá formylace převážně do polohy ortho.
Podmínky reakce
editovatHydroxidy se v chloroformu nerozpouštějí, a tak reakce obvykle probíhá v dvoufázové soustavě. První fázi tvoří vodný roztok hydroxidu a druhou chloroform. Fáze se smíchají až při samotném provedení reakce, a to prudkým mícháním, pomocí katalyzátorů přenosu fáze nebo emulgačního činidla, jako je například 1,4-dioxan.
Ke spuštění reakce je potřeba zahřívání, ovšem je značně exotermní, a tak poté probíhá samovolně.
Možnosti dalšího využití
editovatReimerova–Tiemannova reakce může být použita i u jiných aromatických hydroxysloučenin, například u naftolů.[8]
Dichlorkarbeny mohou reagovat s alkeny za vzniku dichlorcyklopropanů a s aminy, kdy jsou produkty isokyanidy. Reimerova–Tiemannova reakce tak není dobře využitelná u substrátů obsahujících tyto skupiny. Mnoho sloučenin při zahřívání s hydroxidem také podléhá jiným reakcím.
Srovnání s ostatními metodami
editovatPřímou formylaci aromatických sloučenin lze provést také několika jinými postupy, mezi něž patří Gattermannova reakce, Gattermannova–Kochova reakce, Vilsmeierova–Haackova reakce a Duffova reakce; díky snadnosti a bezpečnosti provedení se však nejčastěji používá reakce Reimerova–Tiemannova, při které jako jediné z těchto reakcí není potřeba kyselé nebo bezvodé prostředí.[3] Gattermannovu–Kochovu a Vilsmeierovu–Haackovu reakci navíc nelze provést u fenolů.
Obměny
editovatPokud se v Reimerově–Tiemannově reakci chloroform nahradí tetrachlormethanem, tak budou vznikat fenolové kyseliny,[9] například se místo salicylaldehydu vytvoří kyselina salicylová.
Reference
editovatV tomto článku byl použit překlad textu z článku Reimer–Tiemann reaction na anglické Wikipedii.
- ↑ K. Reimer; F. Tiemann. Ueber die Einwirkung von Chloroform auf Phenole und besonders aromatische Oxysäuren in alkalischer Lösung. Berichte der Deutschen Chemischen Gesellschaft. 1876, s. 1268–1278. Dostupné online.
- ↑ K. Reimer; Hans Wynberg. The Reimer-Tiemann Reaction. Chemical Reviews. 1960, s. 169–184.
- ↑ a b Hans Wynberg; Egbert Meijer. The Reimer-Tiemann Reaction. [s.l.]: [s.n.], 2005. ISBN 9780471264187. S. 14.
- ↑ William G. Dauben. Organic Reactions, Volume 28. [s.l.]: Wiley-Interscience, 1982. Kapitola The Reimer-Tiemann Reaction, s. 1–36.
- ↑ Hans Wynberg. The Reimer–Tiemann Reaction. Comprehensive Organic Synthesis. 1991, s. 769–775. ISBN 978-0-08-052349-1.
- ↑ Karl Reimer. Ueber eine neue Bildungsweise aromatischer Aldehyde. Berichte der Deutschen Chemischen Gesellschaft. 1876, s. 423–424. Dostupné online. DOI 10.1002/cber.187600901134.
- ↑ Jack Hine; James M. Van Der Veen. The Mechanism of the Reimer-Tiemann Reaction. Journal of the American Chemical Society. 1959, s. 6446–6449. DOI 10.1021/ja01533a028.
- ↑ Alfred Russell; Luther B. Lockhart. 2-HYDROXY-1-NAPHTHALDEHYDE. Organic Syntheses. 1942, s. 63. DOI 10.15227/orgsyn.022.0063.
- ↑ A. V. Gaonkar; J. K. Kirtany. ChemInform Abstract: Reimer-Tiemann Reaction Using Carbon Tetrachloride. ChemInform. 2010, s. 1991. DOI 10.1002/chin.199141092.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Reimerova–Tiemannova reakce na Wikimedia Commons