Organické sloučeniny ruthenia
Organické sloučeniny ruthenia jsou organokovové sloučeniny obsahující vazby mezi atomy ruthenia a uhlíku. Několik takových sloučenin má využití v průmyslové katalýze[1] a organorutheniové sloučeniny mají také možné využití při léčbě nádorů.[2]
Chemickými vlastnostmi se částečně podobají organickým sloučeninám železa, aprotože železo se v periodické tabulce nachází přímo nad rutheniem. Nejčastěji používanými sloučeninami pro přípravu organorutheniových sloučenin jsou chlorid ruthenitý a dodekakarbonyl triruthenia.
Ve svých organokovových sloučeninách může ruthenium zaujímat oxidační čísla od -2 ([Ru(CO)4]2−) do +6 ([RuN(Me)4]−), nejčastější je +2.
-
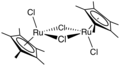
Grubbsův katalyzátor 1. generace
Ligandy
editovatPodobně jako ostatní pozdní přechodné kovy se ruthenium lépe navazuje na měkké ligandy.[3]
Nejvýznamnějšími ligandy ruthenia jsou:
- halogeny, obzvláště chlor
- fosfiny, například trifenylfosfin
- N-heterocyklické karbeny
- cyclopentadienyly
- areny a dieny
- oxid uhelnatý.
- Hydridy přechodných kovů, jako je Shvoův katalyzátor
- komplexy kovů s karbeny, využití mají u Grubbsových katalyzátorů.
Fosfinové ligandy
editovatZatímco monodentátní ligandy, jako jsou trifenylfosfin a tricyklohexylfosfin, se vyskytují nejčastěji, tak jsou také jsou popsány bidentátní ligandy, využívané k přípravám organorutheniových sloučenin. BINAP je použitelný jako asymetrický ligand pro mnoho různých asymetrických rutheniových katalyzátorů.[4][5][6][7]
N-heterocyklické karbeny
editovatN-heterocyklické karbeny (NHC) jsou velmi častými ligandy v organorutheniových komplexech.[8][9]
NHC ligandy lze připravit s vyladěnými sterickými i elektronovými vlastnostmi, mohou být i chirální pro použití v asymetrické katalýze.[10]
NHC se často používají jako náhrady fosfinových ligandů, příkladem může být Grubbsův katalyzátor druhé generace, v němž je fosfin z katalyzátoru první generace nahrazen NHC.
Cyklopentadienylové ligandy
editovatRuthenocen je jako koordinačně nasycená sloučenina nereaktivní a neobsahuje reaktivní skupiny. Švoův katalyzátor ([Ph4(η5-C4CO)]2H]}Ru2(CO)4(μ-H)) je také koordinačně nasycen, ale obsahuje reaktivní OH a RuH skupiny, které umožňují jeho zapojování do přenosových hydrogenací.[11] Používá se při hydrogenacích aldehydů a ketonů, disproporcionacích aldehydů na estery a izomerizacích allylalkoholů.
Chlor(cyklopentadienyl)bis(trifenylfosfin)ruthenium má reaktivní chloroskupinu, kterou lze lehce vyměnit za organické substráty.
Arenové a alkenové ligandy
editovatJako příklad Ru-arenového komplexu lze uvést dimer (cymen)rutheniumdichloridu, prekurzor katalyzátorů přenosových hydrogenací.[12] Acenaftylen vytváří katalyzátor s dodekakarbonylem triruthenia.[13] Hapticita hexamethylbenzenových ligandů u Ru(C6Me6)2 závisí na oxidačním čísle kovového centra.[14]
Ru(COD)(COT) může katalyzovat dimerizaci norbornadienu:
Vícejaderné organorutheniové komplkey byly zkoumány jako možná protinádorová léčiva. Prozkoumány byly dvoj-, troj- a čtyřjaderné komplexy a tetra-, hexa- a okta-metallaklece.[2]
Karbonyly
editovatNejvýznamnějším karbonylem ruthenia je dodekakarbonyl triruthenia, Ru3(CO)12. Analogy Fe(CO)5 a Fe2(CO)9 nemají větší využití. Pentakarbonyl ruthenia se snadno dekarbonyluje:
- Ru3(CO)12 + 3 CO 3 Ru(CO)5
Karbonylací chloridu ruthenitého vznikají ruthenaté Ru(II) chlorokarbonyly, používané jako prekurzory Ru3(CO)12.
Organické sloučeniny osmia
editovatOsmium, těžší prvek 8. skupiny, vytváří komplexy s podobnými vlastnostmi jako ruthenium. Protože je dražší než ruthenium, tak jsou jeho komplexy méně prozkoumané a využívané. Díky svému vysokému obratovému číslu je však oxid osmičelý používán jako významné oxidační činidlo, hlavně při přeměnách alkenů na 1,2-dioly.
5d orbitaly Os mají vyšší energie než 4d orbitaly Ru, což vede k silnější π retrodonaci na alkeny a CO, tedy i tvorbě stabilnějších organických sloučenin, jako jsou například sloučeniny typu [Os(NH3)5(alken)]2+ nebo [Os(NH3)5(aren)]2+.
Významnou skupinou sloučenin, přinejmenším ve výzkumu, jsou karbonyly, jako dodekakarbonyl triosmia a dekakarbonyldihydridotriosmium. Fosfinové komplexy se podobají odpovídajícím komplexům ruthenia, ale jejich hydridové deriváty, například OsHCl(CO)(PPh3)3, bývají stálejší.
Reference
editovatV tomto článku byl použit překlad textu z článku Organoruthenium chemistry na anglické Wikipedii.
- ↑ Synthesis of Organometallic Compounds: A Practical Guide Sanshiro Komiya Ed. S. Komiya, M. Hurano 1997
- ↑ a b Maria V. Babak; Han Ang Wee. Metallo-Drugs:Development and Action of Anticancer Agents. Příprava vydání Astrid Sigel, Helmut Sigel, Eva Freisinger, Roland K. O. Sigel. Berlin: de Gruyter, 2018. doi:10.1515/9783110470734-012. Kapitola Multinuclear Organometallic Ruthenium-Arene Complexes for Cancer Therapy, s. 171–198.
- ↑ P. Barthazy; R. M. Stoop; M. Wörle; A. Togni; A. Mezzetti. Toward Metal-Mediated C-F Bond Formation. Synthesis and Reactivity of the 16-Electron Fluoro Complex [RuF(dppp)2]PF6 (dppp = 1,3-Bis(diphenylphosphino)propane). Organometallics. 2000, s. 2844–2852. doi:10.1021/om0000156.
- ↑ Organic Syntheses, Coll. Vol. 10, p.276 (2004); Vol. 77, p.1 (2000). Link
- ↑ Example: Organic Syntheses, Organic Syntheses, Coll. Vol. 9, p.589 (1998); Vol. 71, p.1 (1993). Link
- ↑ Organic Syntheses, Coll. Vol. 9, p.169 (1998); Vol. 72, p.74 (1995). Link
- ↑ Organic Syntheses, Vol. 81, p.178 (2005). Link
- ↑ K. Öfele; E. Tosh; C. Taubmann; W. A. Herrmann. Carbocyclic Carbene Metal Complexes. Chemical Reviews. 2009, s. 3408–3444. doi:10.1021/cr800516g.
- ↑ C. Samojłowicz; M. Bieniek; K. Grela. Ruthenium-Based Olefin Metathesis Catalysts Bearing N-Heterocyclic Carbene Ligands. Chemical Reviews. 2009, s. 3708–3742. doi:10.1021/cr800524f. PMID 19534492.
- ↑ L. Benhamou; E. Chardon; G. Lavigne; S. Bellemin-Laponnaz; V. César. Synthetic Routes to N-Heterocyclic Carbene Precursors. Chemical Reviews. 2011, s. 2705–2733. doi:10.1021/cr100328e. PMID 21235210.
- ↑ B. Conley; M. Pennington-Boggio; E. Boz; T. Williams. Discovery, Applications, and Catalytic Mechanisms of Shvo's Catalyst. Chemical Reviews. 2010, s. 2294–2312. doi:10.1021/cr9003133. PMID 20095576.
- ↑ Organic Syntheses, Vol. 82, p.10 (2005).[1]
- ↑ Organic Syntheses, Vol. 82, p.188 (2005). [2]
- ↑ Gottfried Huttner; Siegfried Lange; Ernst O. Fischer. Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0). Angewandte Chemie International Edition in English. 1971, s. 556–557. doi:10.1002/anie.197105561.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Organické sloučeniny ruthenia na Wikimedia Commons