MHC glykoprotein II. třídy
MHC glykoproteiny II. třídy (MHCII) jsou povrchové MHC glykoproteiny bílých krvinek, uplatňující se při zahájení specifické imunitní reakce. Hlavní funkcí molekul MHCII je prezentovat T-lymfocytu exogenní peptid, odvozený od pohlceného antigenu, tím T-lymfocyt aktivovat, a spustit tedy imunitní odpověď proti tomuto antigenu.
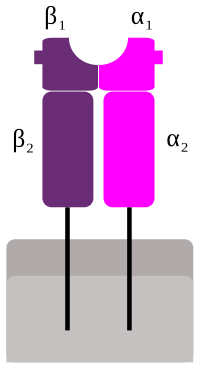
Genová exprese MHCII
editovatMHC glykoproteiny II. třídy jsou exprimovány především profesionálními antigen prezentujícími buňkami (APC), mezi které patří dendritické buňky, makrofágy a B-lymfocyty. Inducibilně mohou MHCII exprimovat neprofesionální APC, např. buňky endotelové, epitelové, nádorové a T-lymfocyty. Geny kódující MHC glykoproteiny II. třídy se nachází v hlavním histokompatibilním komplexu, který se u lidí nachází na VI. a u myší na XVII. chromosomu. Lidé exprimují tři izotypy MHCII (HLA-DP, HLA-DQ a HLA-DR), zatímco myši pouze dva (I-A a I-E).
Struktura
editovatMHCII se skládá ze dvou řetězců, α a β. Na rozdíl od podjednotek MHC I, oba jsou přibližně stejně velké, okolo 30 kDa. Oba dva jsou také zakotveny v membráně a spolu vytvářejí vazebné místo pro peptid, jejž prezentují. Toto MHC II dokáží vázat peptid obvykle o délce 15-35 aminokyselin, ale i delší, což je podstatně více, než u MHCI. To je dáno tím, že žlábek, do nějž se peptid váže, není na koncích uzavřený, ale otevřený, takže peptid může na koncích přesahovat ven.[1] Samotná vazba peptidu se odehrává na srovnatelné délce peptidu.
Antigenní prezentace
editovatNa molekulách MHCII jsou prezentovány hlavně peptidy exogenního původu. Antigeny, ze kterých tyto peptidy vznikají, jsou endocytovány a na MHCII se vážou v buňce. Mezi mechanizmy endocytózy, využívané antigen prezentujícími buňkami, patří fagocytóza, makropinocytóza, endocytóza zprostředkovaná receptorem a endocytóza závislá na klathrinu nebo kaveolinu. Endocytovaný antigen je transportován do specializovaných pozdních endozómů, zvaných také MIIC kompartmenty (MHCII rich compartments). Sem také z Golgiho aparátu přichází MHCII molekuly v komplexu s dalším transmembránovým proteinem, zvaným invariantní řetězec (Ii), který se na ně navázal už v endoplasmatickém retikulu. Funkcí Ii je bránit navázání endogenních peptidů na MHCII během jeho cesty sekretorickou drahou. V MIIC kompartmentu jsou pohlcený antigen a Ii proteolyticky štěpeny a zbytek Ii na MHCII je za pomoci proteinu HLA-DM vyměněn za peptidový fragment, pocházející z antigenu. Komplex peptid-MHCII je následně transportován na povrch buňky, kde je antigen prezentován na TH lymfocytu. Na MHCII mohou být však kromě exogenních peptidů vystavovány i peptidy endogenního původu. Může se jednat o peptidy, pocházející z proteinů rezidentních v endozomálním systému nebo z proteinů, transportovaných tímto systémem do lyzozómů. Na MHCII se také mohou dostat organizmu vlastní peptidy, pocházející z fagocytovaných apoptotických tělísek nebo autofagozómů. [2]
Interakce
editovatPro aktivaci T-lymfocytů je zásadní interakce MHCII s T-buněčným receptorem (TCR) a s jeho koreceptorem CD4 (pro MHCI je to CD8). TCR rozeznává MHC v místě navázaného peptidu. Pro úspěšnou aktivaci T-lymfocytu tak musí specificky rozeznat nejen MHC, ale i peptid exogenního původu, což je principem reakce na patogeny v organismu. CD4 se na MHCII váže bez ohledu na navázaný peptid a umožňuje, aby na MHCII reagovala jen ta podmnožina T-lymfocytů, která CD4 exprimuje, tedy pomocné T-lymfocyty (TH lymfocyty, CD4+ T-lymfocyty). Navíc je k aktivaci T-lymfocytu potřeba ještě kostimulace pomocí CD28, který exprimují pouze APC aktivované signálem nebezpečí, například pomocí Toll-like receptorů. Bez této kostimulace T-lymfocyt přechází do anergie nebo apoptózy.
Imunologická synapse
editovatRozezná-li CD4+ T-lymfocyt pomocí svého antigenního receptoru (TCR) komplex MHCII s peptidem na povrchu APC, dojde k jejich vazbě a následnému vzniku molekulární struktury mezi APC a T-lymfocytem, která se nazývá imunologická synapse (IS). IS lze rozdělit centrální a periferní oblast, respektive cSMAC a pSMAC (supramolecullar activation cluster). Ústředními molekulami cSMAC jsou MHCII a TCR s koreceptorem CD4. Dále je zde molekula CD40 na APC straně IS a její ligand CD40L (= CD154) na T-lymfocytární straně. V cSMAC na T-lymfocyty se také nachází kostimulační molekula CD28, která interaguje s molekulou CD80 nebo CD86 na povrchu APC. Periferii IS (pSMAC) tvoří kruh adhezivních molekul ICAM a LFA-1, důležitých pro stabilitu IS. Součástí IS jsou také cytoplasmatické molekuly lokalizované pod membránou. Patří mezi ně proteiny účastnící se signalizace, vedoucí z receptorů v IS (např. protein kináza Cθ nebo Lck), a regulace cytoskeletu (v T-lymfocytu je do IS orientováno mikrotubuly organizující centrum – MTOC).[3][4]
IS může být strukturou různě stabilní (interakce trvá několik minut až hodin), což je ovlivněno mírou zralosti T-lymfocytu, druhem APC, množstvím antigenu prezentovaného na MHCII a komplexitou prostředí, kde se interakce odehrává. IS může být také do různé míry uspořádaná. Nejvyšší uspořádaností se vyznačuje stabilní monocentrická synapse s přesně vymezeným cSMAC a pSMAC. Od monocentrické IS je pak odvozena sekreční synapse, v jejímž středu se kromě cSMAC nachází další doména, kde probíhá exocytóza aktivních molekul, jako jsou cytokiny nebo granzymy a perforiny. Sekreční synapse je například mezi B-lymfocytem a pomocným T-lymfocytem, který sekretuje cytokiny přispívající k vývoji B-lymfocytu v plazmatickou buňku produkující protilátky. Mezi T lymfocytem a APC mohou dále vznikat méně uspořádané synapse, tzv. multicentrické IS, nebo synapse, kde rozdělení molekul do cSMAC a pSMAC chybí. [5]
Signalizace MHCII
editovatKromě své klasické funkce prezentovat antigen T-lymfocytu slouží MHCII také jako receptor zprostředkovávající signalizaci vedoucí do APC, a ovlivňující tak její další osud. Stimulace MHCII na povrchu dendritických buněk je důležitá pro jejich zrání, produkci cytokinů a podporuje transport komplexů peptid-MHCII na povrch buňky.[6] U B-lymfocytů byla po stimulaci MHCII pozorována jejich proliferace, produkce protilátek a zvýšení adhezivity k T-lymfocytu a exprese kostimulačních molekul CD80 a CD86. Signalizace zprostředkovaná MHCII může tedy vést k proliferaci a diferenciaci APC. Po stimulaci MHCII může být ale také spuštěna apoptóza APC, a signalizace MHCII se tedy může podílet jak na zahájení, tak i na ukončení imunitní odpovědi.[6][7][8][9][10]
Mezi signalizační události po stimulaci MHCII patří: aktivace proteinových kináz z rodiny Src a Syk, protein kinázy C, MAP kináz Erk a p38, fosfatidylinositol-3 kinázy, fosfolipázy Cγ a mobilizace vápníku.[6] [5] Signalizace MHCII také vede k aktivaci transkripčních faktorů NFAT a AP-1.[11]
MHCII má jen velmi krátkou intracelulární část bez signalizačních motivů, a pro přenos signálu z MHCII do buňky je tedy nutná asociace s další signalizační molekulou. Mezi molekuly zprostředkovávající signalizaci MHCII patří CD19, CD20, MPYS a heterodimer Igα/Igβ (=CD79a/CD79b), jehož hlavní funkcí je zprostředkování signalizace BCR.[11][12][13][14] Signalizace MHCII je spouštěna především vazbou TCR při prezentaci antigenu. MHCII může být ale také stimulován vazbou superantigenu, molekuly LAG-3 (=CD223) nebo protilátky proti MHCII, čehož se využívá hlavně experimentálně.[6]
Onemocnění spojená s MHCII
editovatPorucha exprese MHCII způsobuje závažnou imunodeficienci, která se nazývá MHCII deficience nebo také syndrom holých lymfocytů. Nepřítomnost MHCII v imunitním systému vede k poruše vývoje CD4+ T-lymfocytů. V thymu totiž nemůže docházet k jejich pozitivní selekci rozeznáním komplexu peptid-MHCII na thymocytech prezentujících antigen a i když se malé množství CD4+ T-lymfocytů přesto vyvine, nemůže být následně aktivováno antigen prezentujícími buňkami, protože ani ty MHCII neexprimují. Deficit CD4+ T-lymfocytů následně vede k poruše tvorby protilátek, protože B-lymfocyty nedostávají od CD4+ T-lymfocytů pomocný signál. Deficience MHCII není způsobena mutací v genu pro MHCII glykoprotein samotný, ale mutacemi v genech pro jeho transkripční faktory, a to CIIT (MHC class II transactivator), RFXANK, RFX5 nebo RFXAP.
MHCII glykoproteiny hrají také důležitou roli při vzniku autoimunitních onemocnění, některé alely MHCII totiž zvyšují sklon k rozvoji těchto chorob.
| Onemocnění | Alela |
|---|---|
| Goodpastureův syndrom | HLA-DR2 |
| Roztroušená skleróza | HLA-DR2 |
| Gravesova choroba | HLA-DR3 |
| Myasthenia gravis | HLA-DR3 |
| Systémový lupus erythematodes | HLA-DR3 |
| Diabetes mellitus typu I | HLA-DR3/DR4 |
| Revmatoidní artritida | HLA-DR4 |
| Pemphigus vulgaris | HLA-DR4 |
| Hashitomova tyroiditida | HLA-DR5 |
Reference
editovat- ↑ a b HOŘEJŠÍ, Václav; BARTŮŇKOVÁ, Jiřina. Základy imunologie. Praha: Triton, 2009. 320 s. ISBN 9788073872809.
- ↑ TROMBETTA, E. Sergio; MELLMAN, Ira. CELL BIOLOGY OF ANTIGEN PROCESSING IN VITRO AND IN VIVO. S. 975–1028. Annual Review of Immunology [online]. 2005-04 [cit. 2020-12-10]. Roč. 23, čís. 1, s. 975–1028. DOI 10.1146/annurev.immunol.22.012703.104538. PMID 15771591. (anglicky)
- ↑ BOISVERT, Judie; EDMONDSON, Samuel; KRUMMEL, Matthew F. Immunological Synapse Formation Licenses CD40-CD40L Accumulations at T-APC Contact Sites. S. 3647–3652. The Journal of Immunology [online]. 2004-09-15 [cit. 2020-12-10]. Roč. 173, čís. 6, s. 3647–3652. DOI 10.4049/jimmunol.173.6.3647. (anglicky)
- ↑ THAULAND, Timothy J.; PARKER, David C. Diversity in immunological synapse structure: Immunological synapse diversity. S. 466–472. Immunology [online]. 2010-12 [cit. 2020-12-10]. Roč. 131, čís. 4, s. 466–472. Dostupné online. DOI 10.1111/j.1365-2567.2010.03366.x. (anglicky)
- ↑ FRIEDL, Peter; DEN BOER, Annemieke Th.; GUNZER, Matthias. Tuning immune responses: diversity and adaptation of the immunological synapse. S. 532–545. Nature Reviews Immunology [online]. 2005-07 [cit. 2020-12-10]. Roč. 5, čís. 7, s. 532–545. Dostupné online. DOI 10.1038/nri1647. PMID 15999094. (anglicky)
- ↑ a b c d AL-DACCAK, Reem; MOONEY, Nuala; CHARRON, Dominique. MHC class II signaling in antigen-presenting cells. S. 108–113. Current Opinion in Immunology [online]. 2004-02 [cit. 2020-12-10]. Roč. 16, čís. 1, s. 108–113. DOI 10.1016/j.coi.2003.11.006. PMID 14734118. (anglicky)
- ↑ TABATA, Hiroki; MATSUOKA, Takako; ENDO, Fumio; NISHIMURA, Yasuharu; MATSUSHITA, Sho. Ligation of HLA-DR Molecules on B Cells Induces Enhanced Expression of IgM Heavy Chain Genes in Association with Syk Activation. S. 34998–35005. Journal of Biological Chemistry [online]. 2000-11-10 [cit. 2020-12-10]. Roč. 275, čís. 45, s. 34998–35005. Dostupné online. DOI 10.1074/jbc.M002089200. (anglicky)
- ↑ MOURAD, Walid; GEHA, Raif S; CHATILA, Talal. Engagement of major histocompatibility complex class II molecules induces sustained, lymphocyte function-associated molecule 1-dependent cell adhesion.. S. 1513–1516. Journal of Experimental Medicine [online]. 1990-11-01 [cit. 2020-12-10]. Roč. 172, čís. 5, s. 1513–1516. Dostupné online. DOI 10.1084/jem.172.5.1513. PMID 2230655. (anglicky)
- ↑ NABAVI, N.; FREEMAN, G. J.; GAULT, A.; GODFREY, D.; NADLER, L. M.; GLIMCHER, L. H. Signalling through the MHC class II cytoplasmic domain is required for antigen presentation and induces B7 expression. S. 266–268. Nature [online]. 1992-11 [cit. 2020-12-10]. Roč. 360, čís. 6401, s. 266–268. Dostupné online. DOI 10.1038/360266a0. PMID 1279442. (anglicky)
- ↑ NASHAR, Toufic O.; DRAKE, James R. Dynamics of MHC Class II-Activating Signals in Murine Resting B Cells. S. 827–838. The Journal of Immunology [online]. 2006-01-15 [cit. 2020-12-10]. Roč. 176, čís. 2, s. 827–838. DOI 10.4049/jimmunol.176.2.827. (anglicky)
- ↑ a b BOBBITT, Kevin R.; JUSTEMENT, Louis B. Regulation of MHC Class II Signal Transduction by the B Cell Coreceptors CD19 and CD22. S. 5588–5596. The Journal of Immunology [online]. 2000-11-15 [cit. 2020-12-11]. Roč. 165, čís. 10, s. 5588–5596. Dostupné online. DOI 10.4049/jimmunol.165.10.5588. PMID 11067914. (anglicky)
- ↑ LÉVÉILLE, Claire; CASTAIGNE, Jean-Gabriel; CHARRON, Dominique; AL‐DACCAK, Reem. MHC class II isotype-specific signaling complex on human B cells. S. 2282–2291. European Journal of Immunology [online]. 2002 [cit. 2020-12-11]. Roč. 32, čís. 8, s. 2282–2291. Dostupné online. DOI 10.1002/1521-4141(200208)32:8<2282::AID-IMMU2282>3.0.CO;2-M. PMID 12209641. (anglicky)
- ↑ JIN, Lei; WATERMAN, Paul M.; JONSCHER, Karen R.; SHORT, Cindy M.; REISDORPH, Nichole A.; CAMBIER, John C. MPYS, a Novel Membrane Tetraspanner, Is Associated with Major Histocompatibility Complex Class II and Mediates Transduction of Apoptotic Signals. S. 5014–5026. Molecular and Cellular Biology [online]. 2008-08-15 [cit. 2020-12-11]. Roč. 28, čís. 16, s. 5014–5026. Dostupné online. DOI 10.1128/MCB.00640-08. PMID 18559423. (anglicky)
- ↑ JIN, Lei; STOLPA, John C.; YOUNG, Ryan M.; PUGH-BERNARD, Aimee E.; REFAELI, Yosef; CAMBIER, John C. MHC class II structural requirements for the association with Igα/β, and signaling of calcium mobilization and cell death. S. 184–194. Immunology Letters [online]. 2008-03 [cit. 2020-12-11]. Roč. 116, čís. 2, s. 184–194. Dostupné online. DOI 10.1016/j.imlet.2007.11.023. PMID 18194817. (anglicky)
- ↑ Murphy, K.M., P. Travers, and M. Walport, Janeway's Immunobiology2011: Garland Science.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu MHC glykoprotein II. třídy na Wikimedia Commons