Liebeskindova–Šroglova reakce
Liebeskindova–Šroglova reakce je organická reakce thioesteru a boronové kyseliny katalyzovaná kovem, patřící mezi křížová párování.[1]
Reakci objevili dva chemici, český Jiří Šrogl a americký Lanny S. Liebeskind. Reakce má tři generace, na následujícím obrázku je zobrazena první. Používají se Pd0 katalyzátory, TFP (tris(2-furyl)fosfin) a další ligand a stechiometrický kokatalyzátor thiofen-2-karboxylát měďný (CuTC). Následuje obecné schéma reakce:
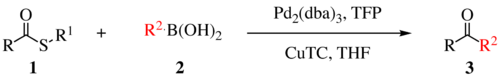
Při Liebeskindových-Šroglových reakcích se používají thioetherové a thioesterové elektrofily a boronové kyseliny nebo stannany jako nukleofily, lze však použít i jiné reaktanty, kromě alkyl- a arylthioesterů může jít i o (hetero)arylthioethery, thioamidy, thioalkyny a thiokyanáty.[2] Do reakce také mohou vstoupit téměř všechny vazby kov-R schopné transmetalace.[2]
Indiové nukleofily nevyžadují přítomnost mědi nebo zásady, jsou však uplatnitelné pouze u první generace, protože druhá a třetí jsou mechanisticky odlišné, navíc probíhají pouze u thioesterů schopných vytvořit šestičlenné metalocykly.

Reakce první generace probíhají za nepřístupu vzduchu, s použitím stechiometrických množství mědi a s palladiovými katalyzátory.[1]
Reakce druhé generace jsou katalyzovány mědí za přítomnosti dodatečného ekvivalentu za přístupu vzduchu a nepřítomnosti palladia.[3] Přidaný ekvivalent oddělí měď od sirné sloučeniny a umožní tím dokončení katalytického cyklu. Tento druh je omezen na thioestery a thioethery a může být také limitován dostupností organoboranu.
Reakce třetí generace mají jako katalyzátor sloučeninu mědi a využívají jediný ekvivalent boronové kyseliny.[4]
Mechanismus
editovatPrvní generace
editovatNíže je zobrazen navržený mechanismus Liebeskindovy–Šroglovy reakce první generace.[5][6]
Thioester 1 reaguje se sloučeninou 3 a vytvoří komplex 4. Oxidační adicí palladia na vazbu uhlík–síra vznikne meziprodukt 5, z něhož se transmetalací vytvoří organopalladiová sloučenina 8. Transmetalace probíhá skrz přesun R2 na palladiové centrum se současným přesunem atomu síry na měďný komplex. Následně se redukční eliminací utvoří keton 3 a obnoví katalyzátor 9.
Druhá generace
editovatNa následujícím obrázku je znázorněn mechanismus druhé generace;[3] neodpovídá běžné posloupnosti oxidační adice-transmetelace-redukční eliminace, jako je tomu u první generace. Společně se zkoumáním reakcí měďných sloučenin s dikyslíkem byl navržen mechanismus zahrnující Cu ve vyšším oxidačním čísle.[7][8][9][10]
Po koordinaci na thioester se Cu+ oxiduje na měďnato-měditý meziprodukt, který funguje jako Lewisova kyselina, jež aktivuje thioester a zajišťuje přesun R2 (buď přímo z atomu boru nebo přes meziprodukt typu Cu-R2), čímž vznikne keton a Cu-thiolát. Druhý ekvivalent boronové kyseliny zajistí rozštěpení vazby Cu-S a uvolnění mědi zpět do katalytického cyklu.
Třetí generace
editovatTřetí generace je založená na katalýze mědí s použitím jediného ekvivalentu boronové kyseliny, čímž napodobuje metallothioneinový (MT) systém, který odstraňuje kovy z organismů.[4] Thiopomocník obsahuje vazbu N-O, která napodobuje vazbu S-S u MT, provádí přitom nezbytné štěpení vazby měď-síra a zajišťuje tím obnovu katalyzátoru. Tato varianta se podporuje působením mikrovlnného záření a nezahrnuje palladium. Pravděpodobně se mechanismem podobá druhé generaci (ke znázornění je použita aktivní sloučenina Cu+-R2, R2 lze však přesunout přímo na boronovou kyselinu), ale měď zpět do katalytického cyklu uvolňuje thiopomocník, nikoliv další ekvivalent boronové kyseliny.
Využití
editovatLiebeskindova–Šroglova párování jsou součástmi několika totálních syntéz, příkladem může být syntéza goniodominu A.[11]
Liebeskindovo–Šroglovo párování bylo také použito k vytvoření uhlíkatého řetězce viridinu s vysokou výtěžností v několikagramovém měřítku.[12]
Další látkou připravenou s využitím této reakce je amfidinolid F,[13] Liebeskindovou-Šroglovou reakcí zde byl vytvořen „severovýchodní“ fragment makrocyklu a terpenový řetězec.
Řízená difunkcionalizace
editovatSloučeniny obsahující dvě thioetherové vazby mohou být na jedné z nich selektivně funkcionalizované za přítomnosti jednoho ekvivalentu nukleofilu, jestliže je přítomna karbonylová skupina.[14]
Tato reakce probíhá přes pětičlenný palladacyklus, u kterého probíhá oxidační adice do polohy cis. Další ekvivalent nukleofilu vyvolá funkcionalizaci v poloze trans.
Reference
editovatV tomto článku byl použit překlad textu z článku Liebeskind–Srogl coupling na anglické Wikipedii.
- ↑ a b L. Liebeskind; Jiri Srogl. Thiol Ester−Boronic Acid Coupling. A Mechanistically Unprecedented and General Ketone Synthesis. Journal of the American Chemical Society. 2000, s. 11260–11261. DOI 10.1021/ja005613q.
- ↑ a b Hong-Gang Cheng; Han Chen; Yue Liu; Qianghui Zhou. The Liebeskind-Srogl Cross-Coupling Reaction and its Synthetic Applications. Asian Journal of Organic Chemistry. 2018, s. 490–508. DOI 10.1002/ajoc.201700651.
- ↑ a b Janette M. Villalobos; Jiri Srogl; Lanny S. Liebeskind. A New Paradigm for Carbon−Carbon Bond Formation: Aerobic, Copper-Templated Cross-Coupling. Journal of the American Chemical Society. 2007, s. 15734–15735. ISSN 0002-7863. DOI 10.1021/ja074931n. PMID 18047333.
- ↑ a b Zhihui Zhang; Matthew G. Lindale; Lanny S. Liebeskind. Mobilizing Cu(I) for Carbon−Carbon Bond Forming Catalysis in the Presence of Thiolate. Chemical Mimicking of Metallothioneins. Journal of the American Chemical Society. 2011-04-27, s. 6403–6410. ISSN 0002-7863. DOI 10.1021/ja200792m. PMID 21449537.
- ↑ Y. Yu; L. S. Liebeskind. Copper-mediated, palladium-catalyzed coupling of thiol esters with aliphatic organoboron reagents. The Journal of Organic Chemistry. 2004, s. 3554–3557. DOI 10.1021/jo049964p. PMID 15132570.
- ↑ J. M- Villalobos; J. Srogl; L. S. Liebeskind. A new paradigm for carbon–carbon bond formation: aerobic, copper-templated cross-coupling. Journal of the American Chemical Society. 2007, s. 15734–15735. DOI 10.1021/ja074931n. PMID 18047333.
- ↑ Lanying Q. Hatcher; Michael A. Vance; Amy A. Narducci Sarjeant; Edward I. Solomon; Kenneth D. Karlin. Copper−Dioxygen Adducts and the Side-on Peroxo Dicopper(II)/Bis(μ-oxo) Dicopper(III) Equilibrium: Significant Ligand Electronic Effects. Inorganic Chemistry. 2006, s. 3004–3013. ISSN 0020-1669. DOI 10.1021/ic052185m. PMID 16562956.
- ↑ Liviu M. Mirica; Deanne Jackson Rudd; Michael A. Vance; Edward I. Solomon; Keith O. Hodgson; Britt Hedman; T. Daniel P. Stack. μ-η2:η2-Peroxodicopper(II) Complex with a Secondary Diamine Ligand: A Functional Model of Tyrosinase. Journal of the American Chemical Society. 2006, s. 2654–2665. ISSN 0002-7863. DOI 10.1021/ja056740v. PMID 16492052.
- ↑ Takahiro Matsumoto, Hideki Furutachi, Masashi Kobino, Masato Tomii, Shigenori Nagatomo, Takehiko Tosha, Takao Osako, Shuhei Fujinami, Shinobu Itoh. Intramolecular Arene Hydroxylation versus Intermolecular Olefin Epoxidation by (μ-η2:η2-Peroxo)dicopper(II) Complex Supported by Dinucleating Ligand. Journal of the American Chemical Society. 2006, s. 3874–3875. ISSN 0002-7863. DOI 10.1021/ja058117g. PMID 16551071.
- ↑ Elizabeth A. Lewis; William B. Tolman. Reactivity of Dioxygen−Copper Systems. Chemical Reviews. 2004, s. 1047–1076. ISSN 0009-2665. DOI 10.1021/cr020633r. PMID 14871149.
- ↑ Tomoyuki Saito; Haruhiko Fuwa; Makoto Sasaki. Toward the Total Synthesis of Goniodomin A, An Actin-Targeting Marine Polyether Macrolide: Convergent Synthesis of the C15−C36 Segment. Organic Letters. 2009-11-19, s. 5274–5277. ISSN 1523-7060. DOI 10.1021/ol902217q. PMID 19905029.
- ↑ Matthew Del Bel; Alexander R. Abela; Jeffrey D. Ng; Carlos A. Guerrero. Enantioselective Chemical Syntheses of the Furanosteroids (−)-Viridin and (−)-Viridiol. Journal of the American Chemical Society. 2017-05-24, s. 6819–6822. ISSN 0002-7863. DOI 10.1021/jacs.7b02829. PMID 28463562.
- ↑ Laurent Ferrié; Johan Fenneteau; Bruno Figadère. Total Synthesis of the Marine Macrolide Amphidinolide F. Organic Letters. 2018, s. 3192–3196. Dostupné online. ISSN 1523-7060. DOI 10.1021/acs.orglett.8b01020. PMID 29762038.
- ↑ Weiwei Jin; Wangming Du; Qin Yang; Haifeng Yu; Jiping Chen; Zhengkun Yu. Regio- and Stereoselective Synthesis of Multisubstituted Olefins and Conjugate Dienes by Using α-Oxo Ketene Dithioacetals as the Building Blocks. Organic Letters. 2011-08-19, s. 4272–4275. ISSN 1523-7060. DOI 10.1021/ol201620g. PMID 21761823.
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Liebeskindova–Šroglova reakce na Wikimedia Commons