Fluorid hafničitý
Fluorid hafničitý je anorganická sloučenina s chemickým vzorcem HfF4.
| Fluorid hafničitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Fluorid hafničitý |
| Anglický název | Hafnium tetrafluoride |
| Německý název | Hafnium(IV)-fluorid |
| Sumární vzorec | HfF4 |
| Vzhled | bílé krystaly |
| Identifikace | |
| Registrační číslo CAS | 13709-52-9 |
| EC-no (EINECS/ELINCS/NLP) | 237-258-0 |
| PubChem | 4092293 |
| SMILES | [F-].[F-].[F-].[F-].[Hf+4] |
| InChI | InChI=1S/4FH.Hf/h4*1H;/q;;;;+4/p-4
Key: QHEDSQMUHIMDOL-UHFFFAOYSA-J |
| Vlastnosti | |
| Molární hmotnost | 254,48 g/mol |
| Teplota tání | 762 °C |
| Teplota varu | 970 °C (sublimuje) |
| Hustota | 7,1 g/cm3 |
| Rozpustnost ve vodě | rozkládá se |
| Struktura | |
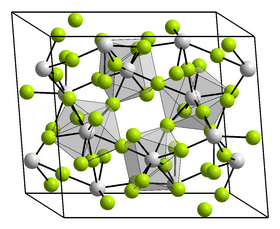
| Krystalová struktura | jednoklonná |
| Hrana krystalové mřížky | a = 1172,5 pm, b = 986,9 pm, c = 763,6 pm |
| Bezpečnost | |
| H-věty | H315, H318, H331, H335 |
| P-věty | P261, P264, P264+265, P271, P280, P302+352, P304+340, P305+354+338, P316, P317, P319, P321, P332+317, P362+364, P403+233, P405, P501 |
Některá data mohou pocházet z datové položky. | |
Příprava
editovatFluorid hafničitý lze připravit reakcí oxidu hafničitého s fluorem:[1]
- HfO2 + 2 F2 → HfF4 + O2
Lze jej také získat fluorací hafnia, karbidu hafničitého nebo boridu hafničitého.[2]
Vlastnosti
editovatFluorid hafničitý je bílá pevná látka[3], která krystalizuje v jednoklonné krystalové soustavě typu fluoridu zirkoničitého s prostorovou grupou C2/c (Číslo 15) a parametry mřížky a = 1172,5 pm, b = 986,9 pm, c = 763,6 pm a β = 126,15°.[4] Je znám také trihydrát fluoridu hafničitého.[5] Sloučenina reaguje s kyselinou fluorovodíkovou za vzniku různých hydrátů (mono- a trihydrátu) a oxyfluoridů.[6]
Reference
editovatV tomto článku byly použity překlady textů z článků Hafnium tetrafluoride na anglické Wikipedii a Hafnium(IV)-fluorid na německé Wikipedii.
- ↑ TOUMANOV, I. N. Plasma and High Frequency Processes for Obtaining and Processing Materials in the Nuclear Fuel Cycle. [s.l.]: Nova Publishers 628 s. Dostupné online. ISBN 978-1-59033-009-8. S. 104. (anglicky)
- ↑ HAGEN, A. P. Inorganic Reactions and Methods, The Formation of Bonds to Halogens (Part 2). [s.l.]: John Wiley & Sons 526 s. Dostupné online. ISBN 978-0-470-14539-5. S. 288. (anglicky)
- ↑ BEZPEČNOSTNÍ LIST Hafnium(IV) fluoride, 99.9% (metals basis) [online]. Thermo Scientific Chemicals [cit. 2023-11-03]. Dostupné online. Dostupné také na: [1].
- ↑ BENNER, G.; MÜLLER, B. G. Zur Kenntnis binärer Fluoride des ZrF 4 ‐Typs: HfF 4 und ThF 4. Zeitschrift für anorganische und allgemeine Chemie. 1990-09, roč. 588, čís. 1, s. 33–42. Dostupné online [cit. 2023-11-03]. ISSN 0044-2313. DOI 10.1002/zaac.19905880105. (anglicky)
- ↑ JOHNSON, B. F. G. Inorganic Chemistry of the Transition Elements: Volume 1. [s.l.]: Royal Society of Chemistry 433 s. Dostupné online. ISBN 978-0-85186-500-3. S. 22. (anglicky)
- ↑ CLARK, R. J. H.; BRADLEY, D. C.; THORNTON, P. The Chemistry of Titanium, Zirconium and Hafnium: Pergamon Texts in Inorganic Chemistry. [s.l.]: Elsevier 151 s. Dostupné online. ISBN 978-1-4831-5921-8. S. 33. (anglicky) Google-Books-ID: 1AJPDAAAQBAJ.


