Acetaldehyd
Acetaldehyd, nazývaný též ethanal či aldehyd kyseliny octové, je bezbarvá těkavá hořlavá kapalina štiplavého zápachu.
| Acetaldehyd | |
|---|---|
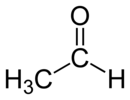 Strukturní vzorec | |
 Prostorový model | |
| Obecné | |
| Systematický název | ethanal |
| Triviální název | acetaldehyd |
| Funkční vzorec | CH3CHO |
| Sumární vzorec | C2H4O |
| Vzhled | bezbarvá kapalina se štiplavou ovocnou vůní |
| Identifikace | |
| Registrační číslo CAS | 75-07-0 |
| EC-no (EINECS/ELINCS/NLP) | 200-836-8 |
| Indexové číslo | 605-003-00-6 |
| Vlastnosti | |
| Molární hmotnost | 44,05 g/mol |
| Teplota tání | −124 °C |
| Teplota varu | 20,2 °C |
| Hustota | 0,788 g/cm³ |
| Rozpustnost ve vodě | neomezeně mísitelný |
| Struktura | |
| Dipólový moment | 2,7 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H224 H319 H335 H341 H350 |
| P-věty | P210 P233 P261 P264 P271 P281 P305+351+308 P403+235 [2] |
| R-věty | R12 R36/37 R40 |
| S-věty | (S2) S16 S33 S36/37 |
| Teplota vzplanutí | −39 °C |
| Teplota vznícení | 185 °C |
Některá data mohou pocházet z datové položky. | |
Výskyt v přírodě
editovatAcetaldehyd se v přírodě vyskytuje ve zralém ovoci, kávě apod. Je produkován rostlinami jako součást jejich metabolismu. V lidském organismu vzniká při metabolizování ethanolu alkoholdehydrogenázou. Stav po vystřízlivění (kocovina) je zčásti způsoben acetaldehydem.
Příprava
editovatAcetaldehyd se připravuje oxidací ethanolu kyslíkem nebo oxidem měďnatým:
- 2 C2H5OH + O2 → 2 CH3CHO + 2 H2O
- C2H5OH + CuO → CH3CHO + Cu + H2O
Může se také připravovat hydratací acetylenu (ethynu):
- HC≡CH + H2O → CH2=CHOH → CH3CHO
Meziproduktem je vinylalkohol, na jehož molekule dochází k přesmyku na acetaldehyd. Touto reakcí se vyrábí acetaldehyd průmyslově.
Lze jej připravit také oxidací ethanolu manganistanem draselným v kyselém prostředí.
Chemické reakce
editovatAcetaldehyd má ve své molekule obsaženou dvojnou vazbu, proto u tohoto aldehydu mohou probíhat adiční reakce, při kterých dochází k rozpadu této násobné vazby. Příkladem je reakce acetaldehydu s ethanolem:
- CH3CHO + C2H5OH → CH3-CH(OH)-O-C2H5
- CH3CHO + 2C2H5OH → CH3-CH(OC2H5)2 + H2O
V prvním případě vzniká ethylacetal ethanalu, ve druhém diethylacetal ethanalu.
Acetaldehyd také reaguje s amoniakem za vzniku sloučeniny, která ve své molekule obsahuje aminovou a hydroxylovou skupinu; její redukcí pak vzniká primární alkohol.
Cyklické polymery aldehydu
editovatPůsobením kyseliny sírové na acetaldehyd vzniká kapalný cyklický trimer nazývaný paraldehyd. Působením plynného chlorovodíku na roztok acetaldehydu vzniká cyklický tetramer metaldehyd, jehož vzorec je (CH3CHO)4.
Použití
editovatAcetaldehyd je důležitým meziproduktem, používá se při výrobě hydroxidu sodného (NaOH) a kyseliny octové, která vzniká jeho oxidací. Polymer paraldehyd se používá jako uspávací prostředek, metaldehyd se používá jako moluskocid.
Odkazy
editovatReference
editovat- ↑ a b Acetaldehyde. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Acetaldehyde [online]. PubChem [cit. 2020-11-27]. Dostupné online.
Související články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu acetaldehyd na Wikimedia Commons
- Slovníkové heslo acetaldehyd ve Wikislovníku


