Cyklohexen
Cyklohexen je cykloalken se vzorcem C6H10. Je meziproduktem při řadě různých průmyslových procesů. Při dlouhodobém vystavení světlu a vzduchu vytváří peroxidy.
| Cyklohexen | |
|---|---|
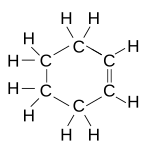 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | cyklohexen |
| Ostatní názvy | tetrahydrobenzen |
| Sumární vzorec | C6H10 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 110-83-8 |
| EC-no (EINECS/ELINCS/NLP) | 203-807-8 |
| ChEBI | 36404 |
| SMILES | C1CCC=CC1 |
| InChI | InChI=1/C6H10/c1-2-4-6-5-3-1/h1-2H,3-6H2 |
| Číslo RTECS | GW2500000 |
| Vlastnosti | |
| Molární hmotnost | 82,144 g/mol |
| Teplota tání | −103,5 °C (169,6 K) |
| Teplota varu | 82,98 °C (356,13 K) |
| Hustota | 0,811 g/cm3 |
| Index lomu | 1,4465 |
| Rozpustnost ve vodě | nerozpustný |
| Tlak páry | 8,93 kPa (20 °C) 11,9 kPa (25 °C) |
| Měrná magnetická susceptibilita | −7,00.105 μm3/g |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R11 R19 R21/22 |
| S-věty | S16 S23 S24 S25 S33 |
| Teplota vzplanutí | −12 °C (261 K) |
| Teplota vznícení | 244 °C (517 K) |
Některá data mohou pocházet z datové položky. | |
Výroba a příprava
editovatCyklohexen se vyrábí částečnou hydrogenací benzenu.[2]
Laboratorní příprava
editovatCyklohexen lze připravit kysele katalyzovanou dehydratací cyklohexanolu a následným oddestilováním z reakční směsi:
Další možností je Dielsova–Alderova reakce buta-1,3-dienu s ethenem.
Reakce
editovatCyklohexen lze přeměnit na cyklohexanol, z něhož dehydrogenací vzniká cyklohexanon, jenž slouží k výrobě kaprolaktamu.[3] Rovněž reaguje s peroxidem vodíku za přítomnosti wolframového katalyzátoru za vzniku kyseliny adipové.[4]
Použití
editovatCyklohexen se používá na výrobu kyseliny adipové a kyseliny maleinové, dicyklohexyladipátu a cyklohexenoxidu. Také nachází využití jako rozpouštědlo.
Struktura
editovatCyklohexen je nejstabilnější v položidličkové konformaci,[5] čímž se liší od cyklohexanu, u něhož má nejnižší energii, a je tedy nejstabilnější, židličková konformace. Ta umožňuje každé vazbě v cyklu zaujmout nezákrytovou konformaci, zatímco molekula cyklohexenu je rovinná, což odpovídá zákrytovým konformacím na jednotlivých vazbách.
Odkazy
editovatSouvisející články
editovatExterní odkazy
editovat- Obrázky, zvuky či videa k tématu Cyklohexen na Wikimedia Commons
Reference
editovatV tomto článku byl použit překlad textu z článku Cyclohexene na anglické Wikipedii.
- ↑ a b Cyclohexene. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Cyclohexanol, method for producing cyclohexanol, and method for producing adipic acid. Původci vynálezu: Naoki NARISAWA, Katsutoshi TANAKA. USA. Patentový spis US9771313 B2. 26 Sep 2017. Dostupné: <online> [cit. 2017-12-04].
- ↑ Michael T. Musser "Cyclohexanol and Cyclohexanone" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.DOI:10.1002/14356007.a08_217
- ↑ Scott M. Reed; James E. Hutchison. Green Chemistry in the Organic Teaching Laboratory: An Environmentally Benign Synthesis of Adipic Acid. Journal of Chemical Education. 2000, s. 1627–1629.
- ↑ Frederick R. Jensen; C. Hackett Bushweller. Conformational preferences and interconversion barriers in cyclohexene and derivatives. Journal of the American Chemical Society. 1969, s. 5774–5782.




