Benzalchlorid
chemická sloučenina
Benzalchlorid (systematickým názvem (dichlormethyl)benzen) je organická sloučenina se vzorcem C6H5CHCl2. Jedná se o bezbarvou kapalinu, která se používá jako reaktant v organické chemii.
| Benzalchlorid | |
|---|---|
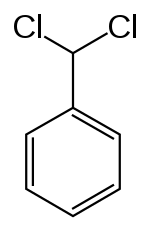 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | (dichlormethyl)benzen |
| Sumární vzorec | C7H6Cl2 |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 98-87-3 |
| PubChem | 7411 |
| SMILES | ClC(Cl)c1ccccc1 |
| InChI | InChI=1/C7H6Cl2/c8-7(9)6-4-2-1-3-5-6/h1-5,7H |
| Vlastnosti | |
| Molární hmotnost | 161,03 g/mol |
| Teplota tání | −17 až −15 °C (256 až 258 K) |
| Teplota varu | 205 °C (478 K) (1,3 kPa) |
| Rozpustnost ve vodě | 0,025 g/100 ml (39 °C) |
| Tlak páry | 0,6 kPa (45 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| R-věty | R22 R23 R37/38 R40 R41 |
| S-věty | S36/37 S38 S45 |
| Teplota vzplanutí | 93 °C (366 K) |
Některá data mohou pocházet z datové položky. | |
Výroba a použití
editovatBenzalchlorid se vyrábí radikálovou chlorací toluenu, při které nejprve vzniká benzylchlorid (C6H5CH2Cl), poté benzalchlorid a nakonec benzotrichlorid (C6H5CCl3):
- C6H5CH3 + Cl2 → C6H5CH2Cl + HCl
- C6H5CH2Cl + Cl2 → C6H5CHCl2 + HCl
- C6H5CHCl2 + Cl2 → C6H5CCl3 + HCl
Benzylhalogenidy jsou obvykle silná alkylační činidla, a tak je benzalchlorid považován za nebezpečnou látku.
Hlavní význam benzalchloridu spočívá v jeho použití jako prekurzoru benzaldehydu. Při této přeměně dochází k hydrolýze za přítomnosti zásady:
- C6H5CHCl2 + H2O → C6H5CHO + 2 HCl
Reference
editovatV tomto článku byl použit překlad textu z článku Benzal chloride na anglické Wikipedii.
- ↑ a b Benzal chloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
Externí odkazy
editovat- Obrázky, zvuky či videa k tématu Benzalchlorid na Wikimedia Commons



